某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为( )
A、铝 B、铜 C、锡 D硅
在铁制品上镀上一定厚度的银层,以下设计方案正确的是 ( )
| A.银用阴极,镀件作阳极,溶液中含有银离子 |
| B.铂作阴极,镀件作阳极,溶液中含有银离子 |
| C.铁作阳极,镀件作阴极,溶液中含有亚铁离子 |
| D.银作阳极,镀件作阴极,溶液中含有银离子 |
在原电池和电解池的电极上所发生的反应,属于还原反应的是()
| A.原电池的正极和电解池的阳极所发生的反应 |
| B.原电池的负极和电解池的阳极所发生的反应 |
| C.原电池的正极和电解池的阴极所发生的反应 |
| D.原电池的负极和电解池的阴极所发生的反应 |
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是()
| A.1/2N2H4(g)+O2(g)====1/2N2(g)+1/2H2O(g);ΔH=+267 kJ·mol-1 |
| B.N2H4(g)+O2(g)====N2(g)+2H2O(g);ΔH =-534 kJ·mol-1 |
| C.N2H4(g)+O2(g)====N2(g)+2H2O(g);ΔH =+534 kJ·mol-1 |
| D.N2H4(g)+O2(g)====N2(g)+2H2O(l);ΔH =-133.5 kJ·mol-1 |
下列各图所表示的反应是吸热反应的是()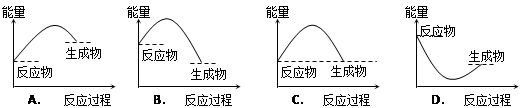
下列说法中不正确的是()
| A.反应热指的是反应过程中吸收或放出的能量 |
| B.热化学方程式的化学计量数可表示分子的个数 |
| C.在热化学方程式中无论反应物还是生成物均必须标明聚集状态 |
| D.所有的化学反应均伴随能量变化 |