向某密闭容器中加入0.3molA, 0.1molC和一定量的B三种气体在一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~tl阶段的c(B)变化未画出]。乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件(浓度、温度、压强、催化剂)且互不相同,t3~t4阶段为使用催化剂。下列说法中正确的是 ( )
A.其他条件不变时,增大压强,B的转化率不变
B.t4~t5阶段改变的条件为降低温度
C.B的起始物质的量为0.02mol
D.若t5~t6阶段改变的条件为升高温度,则正反应为吸热反应
下列说法正确的是( )
A.按系统命名法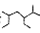 的名称为2一甲基一3,5一二乙基己烷 的名称为2一甲基一3,5一二乙基己烷 |
| B.用Na2 C03溶液能区分CH3COOH、CH3CH2OH,苯、硝基苯四种物质 |
| C.等质量的甲烷、乙烯、1,3一丁二烯分别充分燃烧,所耗氧气的量依次增加 |
| D.下列物质的沸点按由低到高顺序为:(CH3CH2)2CH3<(CH3)3CH<CH3(CH2)3CH3<(CH3)2CHCH2CH3 |
下列说法不正确的是( )
| A.利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学 |
| B.蔗糖、淀粉、油脂及其水解产物均为非电解质 |
| C.通过红外光谱分析可以区分乙醇和乙酸乙酯 |
| D.石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃. |
下列有关物质归类一定正确的是()
①强电解质:氯化氢、氢氧化钡、明矾 ②弱电解质:草酸、纯碱、醋酸铵
③非电解质:液氨、二氧化硫、苯 ④同系物:CH2O2、C2H4O2、C3H6O2
| A.①②③ | B.①③ | C.①④ | D.②③ |
下列说法正确的是( )
| A.用量筒量取硝酸的体积时,俯视读数偏大 |
| B.海带中碘元素提取时氧化滤液中的I-时应加入过量氯水 |
| C.检验火柴头中的氯元素,可把燃尽的火柴头浸泡在少量水中,片刻后取少量溶液于试管中,加亚硝酸钠、AgNO3溶液和稀硝酸 |
| D.金属钾、钠和白磷等暴露在空气中易燃烧,所以金属钾、钠和白磷应保存在煤油中 |
化学与生产、生活密切相关。下列叙述正确的是( )
| A.煤的干馏和石油的分馏均属化学变化 |
| B.BaSO4在医学上用作钡餐,Ba2+对人体无毒 |
C.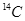 可用于文物年代的鉴定, 可用于文物年代的鉴定,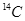 与 与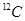 互为同素异形体 互为同素异形体 |
| D.葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |