把少量废铁屑和铝粉的混合物溶于过量稀硫酸中(杂质不反应),过滤,除去杂质,在滤液中加入足量硝酸,再加入过量氨水,有沉淀生成。过滤,加热沉淀至质量不再发生变化,得到残渣。上述沉淀和残渣分别为( )
| A.Fe(OH)3 Al(OH)3 ;Fe2O3 Al2O3 |
| B.Fe(OH)2 Al(OH)3 ;FeO Al2O3 |
| C.Fe(OH)3 Fe(OH)2Al(OH)3 ;Fe3O4 Al2O3 |
| D.Fe2O3 Al2O3;Fe(OH)2 Al(OH)3 |
已知pH=1的某溶液中存在较多的Ba2+、NO3-,则该溶液中还可能大量存在的离子组是()
| A.Fe3+、F-、Cl- | B.Mg2+、SO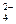 、Br- 、Br- |
| C.Mg2+、Cl-、Fe2+ | D.Na+、NH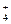 、Cu2+ 、Cu2+ |
石墨能与熔融的金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原子中,比较常见的石墨间隙化合物是青铜色的化合物,其化学式为CxK,其平面图形见图,则x的值为()
| A.8 | B.12 | C.24 | D.60 |
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 + 3C 高温 2 AlN + 3CO ,下列叙述正确的是( )
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中每生成2 mol AlN,N2得到3 mol电子 |
| C.氮化铝中氮元素的化合价为—3 |
| D.氮化铝晶体属于分子晶体 |
xR2++yH++O2=mR3++nH2O的离子方程式,对m和R3+判断正确的是( )
| A.m=4,R3+是氧化产物 | B.m=y,R3+是氧化产物 |
| C.m=2,R3+是还原产物 | D.m=y/2,R3+是还原产物 |
下列化合物,按其晶体的熔点由高到低排列正确的是( )
| A.SiO2 CsCl CBr4 CF4 | B.SiO2 CsCl CF4 CBr4 |
| C.CsCl SiO2 CBr4 CF4 | D.CF4CBr4CsCl SiO2 |