化学平衡移动原理,同样也适用于其他平衡,已知在氨水中存在下列平衡:NH3+H2O  NH3·H2O
NH3·H2O  NH
NH +OH-
+OH-
(1)向氨水中加入MgCl2固体时,平衡向______移动,OH-的浓度_____,NH4+的浓度_______。
(2)向氨水中加入浓盐酸,平衡向______移动;
(3)向浓氨水中加入少量NaOH固体,平衡向_____移动,此时发生的现象是__________。
膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。
(1)A装置是__________,B装置是_____________(填“原电池”或“电解池”)。
(2)N2O5在电解池的__________(填“c极”或“d极”)区生成,其电极反应式为_________________。
(3)A装置中通入O2一极的电极反应式为_________________。
(4)若A装置中通入SO2的速率为2.24 L·min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为____________mL·min-1。
在T ℃条件下,向1 L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) aZ(g)+W(g)ΔH=- Q kJ·mol-1(Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则:
aZ(g)+W(g)ΔH=- Q kJ·mol-1(Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则:
(1)化学计量数a的值为____________。
(2)写出该反应的平衡常数表达式K=____________(a必须用具体的值表示)。
(3)下列说法中能说明该反应达到化学平衡状态的是______________________。
A. 容器内压强一定
B. 容器内气体的密度一定
C. 容器内Z分子数一定
D. 容器内气体的质量一定
(4)X的转化率α=________,Y的平衡浓度为__________mol·L-1(均用含Q、Q1的代数式表示);
(5)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是_________(稀有气体不参与反应)。
A. 2 mol X,1 mol Y,1 mol Ar
B. a mol Z,1 mol W
C. 1 mol X,0.5 mol Y,0.5 mol Z,0.5 mol W
D. 2 mol X,1 mol Y,1 mol Z
已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液_______(填“显酸性”“显碱性”“显中性”或“酸碱性无法确定”),原因是________________________________。
(2)某温度下,向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1KOH溶液至中性,此时溶液中以下关系一定正确的是__________(填字母)。
A. c(H+)·c(OH-)=1×10-14 mol2·L-2
B. c(Na+)+c(K+)=c(HA-)+2c(A2-)
C. c(Na+)>c(K+)
D. c(Na+)+c(K+)="0.05" mol·L-1
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2-(aq)ΔH>0。
Ca2+(aq)+A2-(aq)ΔH>0。
①温度升高时,Ksp_________(填“增大”“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)_________,原因是_________________ (用文字和离子方程式说明)。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式:_________________________________。
反应aA(g)+bB(g) cC(g) (ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g) (ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示: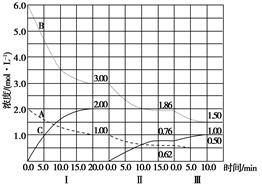
回答问题:
(1)反应的化学方程式中a∶b∶c为_________________;
(2)A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小的排列次序为__________________;
(3)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是________,其值是_______;
(4)由第一次平衡到第二次平衡,平衡移动的方向是______,采取的措施是____________;
(5)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2________T3(填“>”、“<”或“=”),判断的理由是___________;
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10 min 后达到新的平衡,请在下图中用曲线表示第Ⅳ阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C)。
常温下,将一元酸HA(甲、乙、丙、丁代表不同浓度的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 |
HA的物质的量浓度/mol·L-1 |
NaOH物质的量浓度/mol·L-1 |
混合后溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?_______________。
(2)乙组混合溶液中离子的浓度c(A-)和c(Na+)的大小关系是________。
A.前者大B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度大小顺序为________。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=________mol·L-1。