下列工业上制备物质的过程中,无氧化还原反应发生的是
| A.合成氨 | B.从铝土矿中获得铝 | C.玻璃制备 | D.从海水中获得氯气 |
下列化学用语正确的是
A.氮分子的电子式: |
B.CH4分子的球棍模型: |
C.溴化钠的电子式: |
| D.次氯酸的结构式:H—O—Cl |
在热的稀硫酸溶液中溶解了12.16gFeSO4,当加入50mL0.4mol•L-1KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3溶液也完全反应,并有NxOy气体逸出,则该NxOy是
| A.N2O | B.NO | C.N2O3 | D.NO2 |
A、B、C、D、E分别是 Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:(1)A、C均能与稀 H2SO4反应放出气体;(2)B与D的硝酸盐反应,置换出单质D;(3)C与强碱反应放出气体;(4)C、E在冷浓H2SO4中发生钝化反应,由此可以推断A、 B、 C、 D、E依次为
A. Fe、Cu、Al、Ag、Mg B.Al、Cu、Mg、Ag、Fe
C. Mg、Cu、Al、Ag、Fe D.Mg、Ag、Al、Cu、Fe
下列物质转化在给定条件下能实现的是
①Al2O3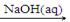 NaAlO2(aq)
NaAlO2(aq) 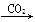 Al(OH)3
Al(OH)3
②S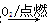 SO3
SO3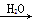 H2SO4
H2SO4
③饱和NaCl(aq)  NaHCO3
NaHCO3 Na2CO3
Na2CO3
④Fe2O3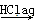 FeCl3(aq)
FeCl3(aq)  无水FeCl3
无水FeCl3
⑤MgCl2(aq) 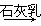 Mg(OH)2
Mg(OH)2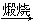 MgO
MgO
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |
根据表中信息,判断下列叙述中正确的是
| 序号 |
氧化剂 |
还原剂 |
其他反应物 |
氧化产物 |
还原产物 |
| ① |
FeBr2 |
/ |
Cl- |
||
| ② |
MnO2 |
浓盐酸 |
/ |
Cl2 |
|
| ③ |
KMnO4 |
H2O2 |
H2SO4 |
O2 |
Mn2+ |
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较:MnO2>Fe3+>Cl2>Br2
C.表中②组反应的氧化产物是MnCl2,1molMnO2电子转移数目是2NA
D.表中③组反应的离子方程式为:2MnO4—+3H2O2+6H+=2Mn2++4O2↑+6H2O