下列实验设计方案中,可行的是
| A.用加入适量铜粉的方法除去Cu(NO3)2溶液中混有的AgNO3 |
B.向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液的SO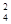 - - |
| C.用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体 |
| D.先后添加酚酞试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
为比较盐酸与醋酸的酸性强弱,下列方案不可行的是(均在常温下测定)
| A.比较等体积、等pH值的两种溶液的导电性 |
| B.比较等物质的量浓度的氯化钠与醋酸钠溶液的pH值 |
| C.比较等体积、等pH值的两种溶液与过量锌粉反应产生氢气的量 |
| D.比较等体积、等物质的量浓度的两种溶液稀释相同倍数后的pH变化 |
下列物质在水溶液中,存在电离平衡的是
| A.Ca(OH)2 | B.CH3COOH | C.BaSO4 | D.CH3COONa |
针对下图所示乙醇分子结构,下述关于乙醇在各种化学反应中化学键断裂情况的说法不正确的是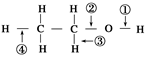
| A.与醋酸、浓硫酸共热时,②键断裂 |
| B.与金属钠反应时,①键断裂 |
| C.与浓硫酸共热至170 ℃时,②、④键断裂 |
| D.在Ag催化下与O2反应时,①、③键断裂 |
下列大小关系正确的是
| A.熔点:己烷>2-甲基丁烷>戊烷>丁烷 |
| B.含氢量:甲烷>乙烷>乙烯>乙炔>苯 |
| C.密度:苯>H2O>CCl4 |
| D.相同物质的量物质完全燃烧耗氧量:己烷>环己烷>苯 |
下列反应中,属于取代反应的是
①CH3CH=CH2+Br2 CH3CHBrCH2Br
CH3CHBrCH2Br ②CH3CH2OH
②CH3CH2OH  CH2=CH2+H2O
CH2=CH2+H2O
③CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O ④ CH3Cl+Cl2→CH2Cl2+HCl
CH3COOCH2CH3+H2O ④ CH3Cl+Cl2→CH2Cl2+HCl
| A.①② | B.③④ | C.①③ | D.②④ |