( 12分)除去下表各溶液中含有的少量杂质(括号内)填写下表:
| 物质(杂质) |
除杂质所需试剂 |
离子方程式 |
| Fe2O3(Al2O3) |
|
|
| FeCl2溶液(FeCl3) |
|
|
| NaHCO3溶液(Na2CO3) |
|
|
火力发电在能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
(1)天然海水呈碱性,写出SO2与OH-反应的离子方程式:。
(2)天然海水吸收了含硫烟气后会溶有H2SO3分子,使用氧气将其氧化的化学原理是
(用化学方程式表示)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是。
某有机物A的结构简式为HOOC—CH==CH—CH2OH。
(1)请你写出该有机物官能团的名称:。
(2)验证该有机物中含有—COOH官能团常采用的方法,产生的现象为。
(3)写出下列反应的化学方程式,并注明反应类型。
①A和溴水反应反应类型:
②A和乙酸反应反应类型:
③A和乙醇反应反应类型:
下表为元素周期表的一部分,请回答有关问题:
| 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 4 |
⑨ |
⑩ |
(1)①和⑤的元素符号是和。
(2)表中最活泼的金属是,非金属性最强的元素是。(填写元素符号)
(3)表中能形成两性氢氧化物的元素是(填写元素符号),分别写出该元素的氢氧化物与⑥⑨最高价氧化物的水化物反应的化学方程式:,
。
(4)⑦和⑩元素形成单质的氧化性的强弱为。(用化学符号表示)证明该结论的一个实验事实(用离子方程式表示)。
现有前四周期的地五种主族元素A、B、C、D、E,A的最高价氧化物含A40%,A原子质子数等于中子数;B是同周期中除稀有气体外原子半径最大的元素;B和D能形成BD型离子化合物,且B、D两离子的电子层结构相同;C和D能形成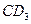 的化合物;C原子比E原子多1个电子;18gC与足量稀硫酸反应,所产生的氢气在标况下的体积为22.4L;C原子中质子数比中子数少1;D原子比A原子多一个质子。则:
的化合物;C原子比E原子多1个电子;18gC与足量稀硫酸反应,所产生的氢气在标况下的体积为22.4L;C原子中质子数比中子数少1;D原子比A原子多一个质子。则:
(1)五种元素的元素符号分别为
A、B、C、D、E、
(2)五种元素中,单质还原性最强的是,简单例子还原性最强的是
(3)A到E五种元素中最高价氧化物对应的水化物中,酸性最强的是碱性最强的是
(4)D单质与B的最高价氧化物对应的水化物的反应的离子方程式为
(5)B、C元素最高价氧化物的水化物之间的化学方程式为
前不久报道,我国“煤变油”技术已进入世界先进行列,科学家通过不懈努力,找到了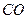 (由煤和水蒸气高温制得)应用的新方法,如:
(由煤和水蒸气高温制得)应用的新方法,如:
(1)合成汽油: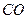 和
和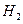 在443—473K的温度下用钴作催化剂,可合成碳原子数为5—8的烷烃。
在443—473K的温度下用钴作催化剂,可合成碳原子数为5—8的烷烃。
①写出 CO合成汽油 的化学方程式
的化学方程式
②若向密闭的合成塔里通入恰好能完全反应的CO和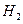 ,当完全反应时,气压降至原来的2/5,(温度不变),此时(填“有”或“没有”)汽油生成,理由是
,当完全反应时,气压降至原来的2/5,(温度不变),此时(填“有”或“没有”)汽油生成,理由是
③要达到上述合成汽油的要求,CO和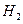 的体积比的取值范围是
的体积比的取值范围是
(2)合成甲醇:在390°C、3.03×105Pa时,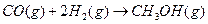 ,以n表示
,以n表示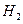 和
和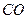 的物质的量之比,a表示
的物质的量之比,a表示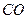 的转化率,x表示达到反应限度时混合物中
的转化率,x表示达到反应限度时混合物中 的体积分数,则
的体积分数,则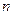 、a、x的关系式为。
、a、x的关系式为。