工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72—和CrO42—的浓度相同
b.2v (Cr2O72—) =v (CrO42—)
c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+ (aq)+3OH—(aq) 常温下,Cr(OH)3的溶度积
Cr3+ (aq)+3OH—(aq) 常温下,Cr(OH)3的溶度积
Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
烃A有如图的转化关系: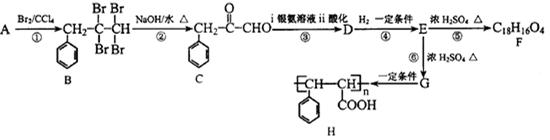
(1)物质C的分子式为____________.物质A的结构简式为_________________,
⑥的反应类型为__________,H中含氧官能团的名称为___________________.
(2)D的核磁共振氢谱图中会出现____________组吸收峰。
(3)写出E-F的化学反应方程式__________________。
(4)G的同分异构体中能同时满足如下条件:
①苯环上只有三个取代基,含有碳碳双键。
②能发生银镜反应,遇氯化铁溶液显紫色。
G共有____种同分异构体(不考虑立体异构),写出其中一种的结构简式____。
铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素。
(1)铁、钴、镍都是很好的配位化合物形成体。
① 在过量氨水中易转化为
在过量氨水中易转化为 。写出
。写出 的价层电子排布图____。
的价层电子排布图____。 中
中 的配位数为____:NH3分子的中心原子杂化方式为____。
的配位数为____:NH3分子的中心原子杂化方式为____。
H2O分子的立体构型为__________。
②铁、镍易与一氧化碳作用形成羰基配合物,如: 等。CO与N2属于等电子体,则CO分子中
等。CO与N2属于等电子体,则CO分子中 键和
键和 键数目比为____,写出与CO互为等电子体的一种阴离子的离子符号____。
键数目比为____,写出与CO互为等电子体的一种阴离子的离子符号____。
(2)+2价和+3价是Fe、Co、Ni等元素常见化合价。NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO____FeO(选填“<”“>”“=”); 某种天然Nio晶体存在如图所示缺陷:一个Niz+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈屯中性。某氧化镍样品组成为 O.该晶体中Ni3+与Ni2+的离子数之比为____。
O.该晶体中Ni3+与Ni2+的离子数之比为____。
工业上,以钛铁矿为原料制备二氧化钛的某工艺流程如下图所示。钛铁矿主要成分
为钛酸亚铁( FeTiO3).其中一部分铁元素在风化过程中会转化为+3价。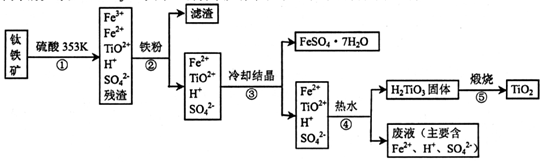
完成下列填空:
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为____。
(2)步骤③中,实现混合物的分离是利用物质的____(填字母序号)。
a.熔沸点差异 b溶解性差异 c氧化性、还原性差异
(3)步骤②、③、④中,均需进行的操作是____(填操作名称)。
(4)可利用生产过程中的废液与软锰矿(主要成分MnO2)反应生产硫酸锰,则反应的离子方程式为
(5)利用下图装置,石墨作阳极,钛网作阴极,熔融CaF2-CaO做电解质,可获得金属钙,钙再作为还原剂,可还原二氧化钛制各金属钛。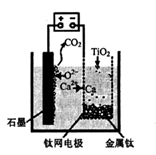
①阳极所发生的反应为________。
②在制备金属钛前后,CaO的总量不变,其原因是____。
(6)_T业上用4.0吨钛铁矿制得1. 6吨的二氧化钛,则钛铁矿中钛元素的质量分数是____。
(假设生产过程中钛没有损失)
甲醇是重要的化工原料和清洁液体燃料。工业上可利用CO或CO2来生产甲醇。甲醇制
备的相关信息如下表:
(1)反应②是____反应(选填“吸热”“放热”)。
(2)据上表信息推导出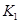 、
、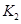 与
与 之间的关系,
之间的关系, =______用
=______用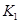 、
、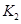 表示)。500℃时测得反应③在某时刻,
表示)。500℃时测得反应③在某时刻,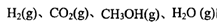 的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时
的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时 (选填“>”“<”“=”)。
(选填“>”“<”“=”)。
(3)若某温度下反应①从开始到平衡CO和CH3OH的浓度变化如图一所示,则用H2浓度变化表示此段时间内该反应的平均速.v(H2)=若某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图二所示,则平衡状态由A变到B时,平衡常数 (选填“>”“<”“=”)。
(选填“>”“<”“=”)。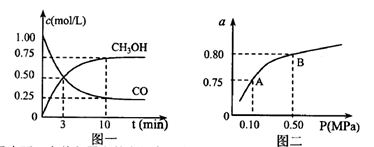
(4)一定温度下,在体积固定的密闭容器中发生反应②,可判断该反应已经达到平衡的是____。(用相应字母表示)
| A.容器中总压强不变 |
| B.混台气体的平均摩尔质量也始终保持不变, |
| C.混合气体的密度不变 |
| D.CO2(g)或CO(g)的浓度不变 |
(5)一定条件下甲醇与一氧化碳反应可合成醋酸。室温下,将a mol/L醋酸溶液与bmol/LNaOH溶液等体积混合。若溶液显中性,则a_________b(选填“>”“<”“=”)。若c(Na+)<c(CH3COO-),则溶液显____性(选填“酸”“碱…中”)。
工业上用黄铜矿冶炼铜及对炉渣综合利用的一种工艺流程如下:
(1)冶炼过程中得到Cu2O和Cu的混合物称为“泡铜”,其与金属A1在高温条件下混合反应可得粗铜,反应化学方程式为________。粗铜精炼时应将粗铜连接在直流电源的____极,可在____极得到纯度较高的精铜。
(2)传统炼铜的方法主要是火法炼铜,其主要反应为:
每生成1 mol Cu,共消耗____mol O2。反应③中的氧化剂是____。
(3)炼铜产生的炉渣(含 )可制备Fe2O3。根据流程回答下列问题:
)可制备Fe2O3。根据流程回答下列问题:
①加入适量NaClO溶液的目的是_______ (用离子方程式表示)。
②除去Al3+的离子方程式是____。
③选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂有:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水。所选试剂是____。实验设计:________。