硝酸铵是农业生产中常用的化学肥料。为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0 g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液。发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O。反应 过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:完成有关计算:
过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:完成有关计算: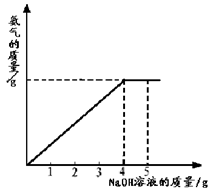
(1)NH4NO3中各元素的质量比为(H:N:O) ;
(2)样品中硝酸铵的质量分数;
(3)所得溶液中NaNO3的质量分数(保留两位小数)。
某课外活动小组,为了检验本地钢铁厂钢产品的质量,在实验室中称取生铁屑样品10.0g,放入烧杯中,加入一定量的稀硫酸,使之充分反应(杂质不参加反应)。然后冷却,称量。反应后烧杯中物质的质量比反应前减少了0.34g。计算:
⑴生铁中杂质的质量分数。
⑵冶炼100吨这种生铁,至少需要含有氧化铁80%的赤铁矿多少吨。
某课外化学活动小组利用稀硫酸测定粗锌中纯锌的含量。现称取粗锌20g,加入到足量稀硫酸溶液中充分反应(杂质不参与反应),测得数据如下表:
| 时间(min) |
0 |
3 |
6 |
9 |
| 粗锌及溶液总质量(g) |
150.4 |
150.2 |
150.0 |
150.0 |
(1)计算反应过程中产生氢气的质量。
(2)根据表中数据计算粗锌中锌的质量分数。
化肥尿素[CO(NH2)2]中碳、氧、氮、氢四种元素的原子个数比为,其相对分子质量为,
(2)尿素[CO(NH2)2]中氮元素质量分数是
【计算过程】
(2)如果市场上尿素价格2400元/吨,若有1200元钱去买尿素,可以买吨氮元素。
【计算过程】
(3)在公共场所有一广告牌,如右图所示。这是一则(填“真实”或“虚假”)的广告。理由是
如图所示,有人制作了一个家庭制氧装置。该制氧装置由2个饮料瓶、2根软管和药剂构成,整套装置成本不到3块钱。药剂包括过氧碳酸钠(2Na2CO3?3H2O2)和二氧化锰。制氧时,先在两个饮料瓶中加入适量的水,再往甲瓶中加入药剂,产生的气体通过B管从乙瓶导出,即可供人吸氧。
(1)为了顺利地导出甲瓶中产生的氧气,A软管在甲瓶中应_____________。
(选填“不伸入液面”或“伸入液面”)
(2)药剂加入水中后会发生以下两个反应:
2Na2CO3?3H2O2 =" 2Na2CO3+3H2O2" ;2H2O2 2H2O+O2↑
2H2O+O2↑
从化学反应的基本类型来看,它们都属于______________反应。
(3)已知总质量为110克的药剂可产生34克过氧化氢,则这包药剂完全反应会生成多少克氧气?
国家规定,酿造食醋的总酸含量标准为3.5-5.0/100mL(总酸含量即100 mL食醋中含醋酸的质量)。某兴趣小组为测定一市售的总酸含量,进行了实验。实验后,得知10.0mL该食醋样品与7.5g溶质的质量分数为4%的氢氧化钠溶液恰好完全反应。计算该市售食醋样品中的总酸含量,并说明是否符合国家标准。(醋酸和氢氧化钠反应的化学方程式:CH3COOH+NaOH=CH3COONa+H2O假设该市售食醋样品中其他物质不与氢氧化钠发生反应)