化肥尿素[CO(NH2)2]中碳、氧、氮、氢四种元素的原子个数比为 ,其相对分子质量为 ,
(2)尿素[CO(NH2)2]中氮元素质量分数是
【计算过程】
(2)如果市场上尿素价格2400元/吨,若有1200元钱去买尿素,可以买 吨氮元素。
【计算过程】
(3)在公共场所有一广告牌,如右图所示。这是一则 (填“真实”或“虚假”)的广告。理由是
氯化铵是一种常见的化学肥料,请根据题给信息回答:
(1)氯化铵(NH4Cl)的相对分子质量是;氮元素与氯元素的质量比为
(2)右图为氯化铵溶解度曲线图,在70℃时,氯化铵的溶解度约为g;在此温度下,氯化铵饱和溶液中溶质质量分数是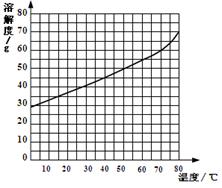
将11g含少量杂质(杂质不溶于水,也不溶于酸)的碳酸钠固体,加入到43.8g稀盐酸中,恰好完全反应,产生二氧化碳气体4.4g,请计算:
(1)求原固体中碳酸钠的质量;
(2)求反应后的溶液中氯化钠的质量分数。
甲醛是室内装修的隐形杀手,甲醛的化学式为CH2O。
(1)甲醛中碳、氢、氧的质量比为;(2)甲醛中碳元素的质量分数为
某化学兴趣小组为测定大理石中碳酸钙的含量,将过量的稀盐酸加入到20 g大理石中(其它成分不与盐酸反应),把产生的CO2气体用足量的NaOH溶液吸收,同时测量2分钟内NaOH溶液增加的质量,结果如下表所示:
| 时间/s |
O |
20 |
40 |
60 |
80 |
100 |
120 |
| 增加的质量/g |
O |
3.O |
5.O |
6.O |
6.6 |
6.6 |
6.6 |
试回答下列问题:
(1)请在右边的坐标纸上,以反应时间为横坐标,以产生CO2气体的质量为纵坐标,画出能够表明产生气体的质量随时间变化规律的关系曲线;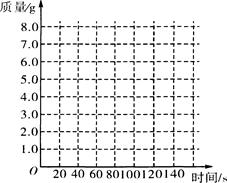
(2)从表中可以看出,20 g大理石样品与盐酸反应生成的CO2质量最多是g;
(3)计算大理石样品中碳酸钙的质量分数。
为了测定一瓶过氧化氢溶液的溶质质量分数,取
过氧化氢溶液于烧杯中,加入
二氧化锰,充分反应至烧杯中物质质量不再减轻,称量烧杯中剩余物质质量为
,假设生成的气体全部逸出.
(1)根据质量守恒定律可知,生成氧气的质量为
;
(2)计算这瓶过氧化氢溶液中溶质的质量分数(计算结果精确到
).