往含等物质的量CO32-和HCO3-的溶液中滴入HCl溶液,下列表示产生的气体在标准状况下的体积与加入的HCl溶液体积关系图正确的是
A. B. C. D.
50℃时,在0.1mol/L的Na2S、NaHS两溶液中均存在的 关系是
关系是
A.c(H+)·c(OH-) = 1×10-14 |
B.c(Na+)=c(S2-)+c(HS-)+c(H2S) |
C.c(OH-)=c(H+)+c(HS-)+2c(H 2S) 2S) |
D.c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
以下自发反应可用ΔH判据来解释的是
A.2H 2(g)+O2(g)====2H2O(l)ΔH="-285.8" kJ·mol- 2(g)+O2(g)====2H2O(l)ΔH="-285.8" kJ·mol- |
B.2N2O5(g)====4NO2(g)+O2(g) ΔH="+56.7" kJ·mol-1 ΔH="+56.7" kJ·mol-1 |
| C.(NH4)2CO3(s)====NH4HCO3(s)+NH3(g)ΔH="+74.9" kJ·mol-1 |
| D.硝酸铵自发地溶于水 |
可逆反应H2(g)+I2(g) 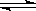 2HI(g)
2HI(g) H<0达到平衡后,当改变外界条件如物质浓度、体系压强、温度等而发生下列各选项的变化时,能作为平衡一定发生了移动的标志的是
H<0达到平衡后,当改变外界条件如物质浓度、体系压强、温度等而发生下列各选项的变化时,能作为平衡一定发生了移动的标志的是
| A.气体的密度变小了 | B.反应物和生成物浓度均变为原来的2倍 |
| C.气体的颜色变深了 | D.体系的温度发生了变化 |
下列各组物质全部是弱电解质的是
| A.H2O、NH3·H2O、H3PO4、HF |
| B.Cu(OH)2、CH3COOH、C2H5OH、CH3COONa |
| C.H2SO3、Ba(OH)2、BaSO4 |
| D.H2SiO3、H2S、CO2 |
放热反应CO(g)+H2O(g)  CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)="1.0" mol·L-1,其平衡常数为K1。其他条件不变升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)="1.0" mol·L-1,其平衡常数为K1。其他条件不变升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
| A.若增大CO浓度,K2和K1都增大 | B.K 2>K 1 |
| C.c2(CO)=c2(H2O) | D.c1(CO)>c2(CO) |