研究NO2、SO2、CO等大气污染气体的处理有重要意义。
(1)NO2可用水吸收,相应的化学方程式为______。
利用反应6NO2+8NH3 7N2+12H2O
7N2+12H2O
也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______L。
(2)已知:2SO2(g)+ O2 (g)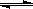 2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1
2NO(g)+ O2 (g) 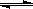 2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1
则反应NO2(g)+ SO2 (g) 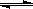 SO3 (g) +NO(g) △H =______kJ·mol-1
SO3 (g) +NO(g) △H =______kJ·mol-1
一定条件下,将体积比为1:2的 NO2和 SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变 d.每消耗1molSO3的同时生成1molNO2
测得上述反应平衡时的NO2与SO2体积比为1:6,则平衡常数K=______。
(3)CO可用于合成甲醇,反应方程式为CO(g)+ 2H2 (g) 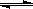 CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应△H _____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________。
CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应△H _____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________。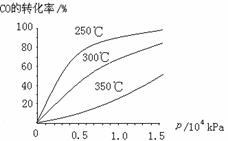
常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式__________________________。
(2)若溶液M由10mL 2 mol·L-1NaHA溶液与10mL 2mol·L-1NaOH溶液混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为。(溶液混合时体积变化忽略,下同)
(3)已知Ksp(BaA)= 1.8×10-10,向⑵的混合溶液中加入10mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为___________ mol·L-1。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为___________(填“大于、等于、小于”或“均有可能”)。
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca。
(1)Ca的原子结构示意图。
(2)配平用钙线氧脱鳞的化学方程式:
P + FeO + CaO  Ca3(PO4)2 + Fe
Ca3(PO4)2 + Fe
(3)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n。则金属M为_________,检测Mn+ 的方法是_____________________(用离子方程式表达)。
(4)取1.6g钙线试样,与水充分反应,生成224ml H2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3g。
(5)处理炼钢厂含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知:CO(g) + 1/2 O2(g) ="=" CO2(g) H = -283.0 kJ·mol-2
H = -283.0 kJ·mol-2
S(s) + O2(g) ="=" YO2(g) H = -296.0 kJ·mol-1
H = -296.0 kJ·mol-1
此反应的热化学方程式是 。
金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下图所示:
其中,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1)当Al与稀硝酸反应时,稀硝酸表现的性质是
A.只表现强氧化性
B.只表现酸性
C.同时表现强氧化性及酸性
D.表现了强氧化性还表现了还原性
(2)在下列离子方程式的横线上填写产物的化学式(不需要配平)
Al + NO3-+ OH-+ H2O—→ +
(3)过量D的水溶液与A溶液反应的离子方程式是
(4)D—→C反应的化学方程式是
(5)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质是
(6)除去C中的E气体杂质可用的化学方法是:(用化学方程式表示)
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 。
(选修—有机化学基础)苯酚是重要的化工原料,通过下列流程可合成阿司匹林、冬青油和一些高分子化合物。已知:
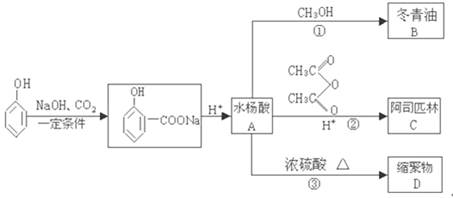
试按要求回答:
(1)由水杨酸A合成阿司匹林C的反应类型是。
(2)写出C、D的结构简式:C,D。
(3)写由水杨酸A合成冬青油B的化学方程式: 。
(4)水杨酸A易溶于冬青油中使产品不纯,用NaHCO3溶液反应后,经过操作得到较纯净的冬青油,写出A与NaHCO3溶液反应的化学方程式:。
(5)阿斯匹林药片需要保存在干燥处,受潮的药片易变质不宜服用;检验受潮药片是否变质的试剂是(写出一种试剂即可)。
(选修—化学与技术)
(1)工业上以粗铜为原料采取如图1所示流程制备硝酸铜晶体: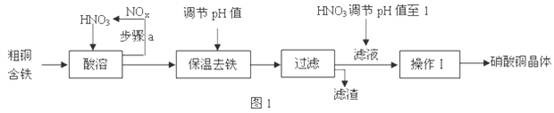
①在步骤a中,还需要通入氧气和水,其目的是。
②在保温去铁的过程中,为使Fe3+沉淀完全,根据下表数据,溶液的pH值应保持在范围。调节pH值时,可以向溶液中加入的试剂是()
(a) NaOH溶液 (b) 氨水 (c) Cu(OH)2 (d) CuO
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
| Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
③在操作Ⅰ之前,对滤液用HNO3调节pH值至1,其目的是(结合离子方程式说明)。
④从滤液中制取硝酸铜晶体的操作Ⅰ的具体步骤是。
(2)图2是某小组学生查阅资料后所绘出的硝酸铜晶体[Cu(NO3)2 nH2O]的溶解度曲线(温度在300C左右对应不同的晶体),下列说法正确的是()
(a) A点时的溶液为不饱和溶液
(b) B点时两种晶体可以共存
(c)按上述流程最终得到的晶体一定是Cu(NO3)2 3H2O
(d) 若将C点时的溶液降温至300C以下,可以析出Cu(NO3)2 6H2O晶体