下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 |
A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
| 原子半径(10-10m) |
1、02 |
2、27 |
0、74 |
1、43 |
0、77 |
1、10 |
0、99 |
1、86 |
0、75 |
1、17 |
| 最高价态 |
+6 |
+1 |
— |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
+4 |
| 最低价态 |
-2 |
— |
-2 |
— |
-4 |
-3 |
-1 |
— |
-3 |
-4 |
试回答下列问题:
(1)已知H为Na元素,则以上10种元素中第一电离能最小的是: 。(写元素符号)。比元素B原子序数大10的元素其基态原子的核外电子排布式是 。
(2)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其一分子中共形成 个σ键, 个π键。
(3)短周期某主族元素K的电离能情况如图(A)所示。则K元素位于周期表的第 族。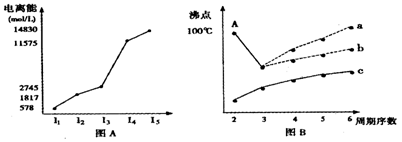
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。
②不同同学对某主族元素的氢化物的沸点的变化趋势画出了两条折线—折线a和折线b,你认为正确的是 ,理由是 。
下表中a、b、c…为周期表中部分元素,回答下列问
| a |
|||||||||||||||||
| f |
y |
h |
i |
||||||||||||||
| b |
e |
j |
|||||||||||||||
| c |
d |
g |
l |
||||||||||||||
(1)在表中用线画出元素周期表的边界
(2)请写出上述元素d3+的核外电子排布式;
(3)请比较y、h、i三种元素的第一电离能由大到小的顺序(写元素符号),判断依据是:
(4)请写出e元素的原子价电子轨道表示式;
(5)ya3分子的电子式是,其分子的空间构型是。
(6)e元素最高价氧化物对应的水化物呈_______性(酸性、碱性或两性),用离子方程式说明____________________________________________。
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)该反应体系的平衡常数表达式为:
(2)若平衡体系的pH=2,则溶液显色.
(3)能说明第①步反应达平衡状态的是。
a.溶液的颜色不变 b.2v (Cr2O72—) ="v" (CrO42—)
c. Cr2O72—和CrO42—的浓度相同
(4)完成第②步反应的离子方程式:
__Cr2O72—+ __Fe2+ +_____="__" Cr3+ + __Fe3+ +__ H2O
(5)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH—(aq)
Cr3+(aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)· c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至。
方法2:电解法
该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(6)写出电解过程中的电极反应式:
阳极:。阴极: 。
(7)溶液中同时生成的沉淀还有。
A、B、C、D、E、F五种短周期元素的原子序数依次增大。周期表中A元素的原子半径最小,B形成化合物种类最多,C是空气中含量最多的元素,D是地壳中含量最多的元素,短周期主族元素中E的原子半径最大且其单质能与冷水剧烈反应,F既能与盐酸反应也能与烧碱溶液反应制得A单质。
(1)B在周期表中的位置是____________________,C的原子结构示意图为________
(2)A、B形成的最简单化合物名称是___________,分子构型是__________________
(3)BD2的结构式为:__________。已知:298K,BD生成1molBD2(g)时放出热量283.0kJ·mol-1,B单质生成1molBD2(g)时放出热量393.5kJ·mol-1,则B单质反应生成BD的热化学方程式为。
(4)室温时,仅由B、D、E三种元素形成的某种常见的离子化合物水溶液的pH_____7(填“>”、“=”或“<”),理由是(用离子方程式表示)_________________________________
(5)硒(se)是人体必需的微量元素,与D同一主族,Se原子比D原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_________。
(6)F的最高价氧化物与E的最高价氧化物的水化物反应的离子方程式是
__________________________________________________________
(7)A单质和D单质可组成最简单的燃料电池,若用稀硫酸作电解质,该电池的正极反应式是:______________________________________________
(1)在25℃条件下将pH=3的醋酸稀释100倍后溶液的pH为
| A.5 | B.1 | C.1~3之间 | D.3~5之间 |
(2)常温下,pH=3的盐酸和pH=11的氨水等体积混合后,混合溶液中
c(Cl-)c(NH4+)(填“>”、“=”或“<”)。
(3)常温下,已知某CH3COONa溶液中的c(Na+)=c(CH3COO一),则该溶液的pH7(填“>”、“=”或“<”)。
(4)如果将NaOH和NH4Cl溶液等浓度、等体积混合,则混合溶液中各离子浓度由大到小的顺序为:c( )c( )c( )c( )c( )
[括号内填离子符号,“”上填写“>”或“=”]
(5)常温下等物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+) 由大到小的顺序是:_____________________________(填序号)
(12分)已知丙酮与柠檬醛在一定条件下反应可以合成假紫罗兰酮,再进一步可以合成有工业价值的紫罗兰酮,如:
又知卤代烃可以发生水解
又知可发生下面反应: ,
,
下图是合成有机物A的路线图,反应条件和一些不必列出的产物等均已删去.
(1)写出结构简式
②________________⑤_________________⑥________________。
(2)写出化学方程式
①→②________________________ ④→⑤_________________________。