、对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25℃时有HA H++A―,则K=
H++A―,则K= 。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
回答下列问题:
(1)当升高温度时,K值____(填“变大”“变小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系? ____ ________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、
H2PO4-、HPO42-都看做是酸,其中酸性最强的是_ ,最弱的是_ __。
(4)同一多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是_____________,产生此规律的原因是_____________ ___。
(5) Na2CO3溶液呈_ _(填“酸性”“碱性”或“中性”),其原因(用离子方程式表示)是_ 。
(6)已知NaH2PO4溶液呈酸性,则该溶液中c(H3PO4)____c(HPO42-)(填“大于”或“小于” )。
肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体。
(1)肉桂酸甲酯由C、H、O三种元素组成,质谱分析其分子的相对分子质量为162,核磁共振氢谱谱图显示有6个峰,其面积之比为1︰2︰2︰1︰1︰3 ,利用红外光谱仪检测其中的某些基团,测得红外光谱如下图: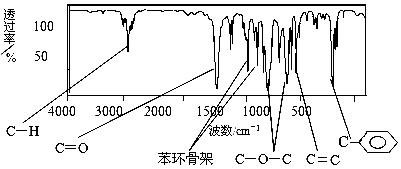
则肉桂酸甲酯的结构简式是 (不考虑立体异构)。
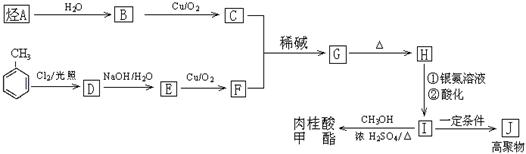
(2)已知:
I.醛与醛能发生反应,原理如下:
|


下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp (25℃)。
回答下列问题:
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为(须填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式:;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)
c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10ml 0.01mol/L苯酚溶液中滴加Vml 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是;
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c((NH4+) >c (C6H5O-) >c (H+)>c (OH-)
C.V=10时,混合液中水的电离程度小于10ml 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c (NH4+)= c (C6H5O-)+ c (C6H5OH)
(5)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式。
(6)Ⅰ.如下图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
① T1T2(填>、=、<),
T2温度时Ksp(BaSO4)= ;
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
Ⅱ.现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为 1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理次。[提示: BaSO4(s)+ CO32- (aq)
1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理次。[提示: BaSO4(s)+ CO32- (aq) BaCO3(s)+ SO42- (aq) ]
BaCO3(s)+ SO42- (aq) ]
燃煤废气、汽车尾气中的氮氧化物(NOx)、一氧化碳等有害气体,常用下列方法处理,以减少对环境的污染。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJ·mol-1
则1molCH4将NO2还原为N2的反应热为;
(2)除氮氧化物及CO外,汽车尾气中 还含有碳氢化合物等污染物,下图是汽车尾气转化研究的示意图:表示的是Pt/Al2O3/Ba表面吸附与解吸作用的机理,氮氧
还含有碳氢化合物等污染物,下图是汽车尾气转化研究的示意图:表示的是Pt/Al2O3/Ba表面吸附与解吸作用的机理,氮氧 化物是NO2,碳氢化合物是CxHy
化物是NO2,碳氢化合物是CxHy ,写出两者反应的化学方程式:,Pt/Al2O3/Ba的作用是;
,写出两者反应的化学方程式:,Pt/Al2O3/Ba的作用是;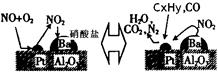
(3)平衡常数K的数值大小,是衡量化学反应进行程度的标志,K的数值越大,化学反应的限度越大,反应物反应的越充分。在25℃时,下列反应的平衡常数如下:
N2(g)+O2(g)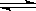 2NO(g)K1=1×10-30㈠
2NO(g)K1=1×10-30㈠
2H2(g)+O2(g)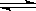 2H2O(g) K2=2×1081㈡
2H2O(g) K2=2×1081㈡
2CO2 (g)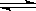 2CO(g)+O2(g)K3=4×10-92㈢
2CO(g)+O2(g)K3=4×10-92㈢ ①常温下,反应2H2O(g) 2H2(g)
①常温下,反应2H2O(g) 2H2(g) +O2(g) 平衡常数K=;
+O2(g) 平衡常数K=;
②关于以上反应,下列说法正确的是
A. 常温下,NO,H2O,CO2三种化合物分解放出氧气的倾向大小顺序:NO>H2O>CO2 常温下,NO,H2O,CO2三种化合物分解放出氧气的倾向大小顺序:NO>H2O>CO2 |
| B.若升高温度,反应㈢的平衡常数K3将增大 |
| C.若只增加压强,且反应物、生成物状态不变,反应㈠平衡不发生移动,平衡常数不变;反应㈡平衡朝正向移动,平衡常数增大 |
| D.若增加汽车发动机空气的进气量,可同时减少氮氧化物和一氧化碳的排放 |
③基于环保法规,要求改装汽车尾气处理装置,达到使氮氧化物(NO)、一氧化碳转化为无污染、可排放的气体的目的。改装的方法主要是加入有效催化剂,请你根据以上有关数据分析,在不改变其它条件的情况下,可使用催化剂除污染气体的原因:。
天宫一号(Tiangong-1)是中国第一个目标飞行器,于2011年9月29日21时16分3秒在酒泉卫星发射中心发射,它的发射标志着中国迈入中国航天“三步走”战略的第二步。天宫一号是由长征二号大推力火箭发射升空的,火箭推进剂是成功发射火箭的重要因素,推进剂的发展经历了一个漫长的过程。
(1)20世纪前,黑火药是世界上唯一的火箭用推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为2KNO3+ S + 3C ="=" K2S + N2 ↑+ 3CO2 ↑。
①写出K2S的电子式:;
②某化学兴趣小组进行了如下实验:
实验一:取适量黑火药溶于水,过滤,将滤液蒸发浓缩,冷却后慢慢 加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式:
加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式:
;
实验 二:取黑火药爆炸后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量,
二:取黑火药爆炸后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量, 一开始溶液变浑浊后又变澄清。请设计实验方案证明该澄清溶液中含有Cl-:;
一开始溶液变浑浊后又变澄清。请设计实验方案证明该澄清溶液中含有Cl-:;
(2) 1947年,研制出第二代聚硫橡胶、高氯酸铵、铝粉复合推进剂。高氯酸铵受撞击会引发剧烈爆炸,其爆炸产物有4种,2种产物是空气中的主要成分,另一种气体产物能使湿润的蓝色石蕊试纸变红,写出该反应的化学方程式:;
(3)20世纪60年代,美国大推力火箭使用的是液体推进剂,常用的氧化剂有双氧水、四氧化二氮、液氧;可燃物有肼(N2H4)、一甲肼、偏二甲肼、液氢等。火箭发射时将两种液体分别注入火箭发动机的燃烧室中燃烧。偏 二甲肼的系统命名为1,1-二甲基联氨,它的结构简式为;
二甲肼的系统命名为1,1-二甲基联氨,它的结构简式为;
(4)以上的火箭推进剂一般都含有氮元素,含氮化合物种类丰富,科学家从化肥厂生产的硫酸铵中检出组成为N4H4(SO4)2的物质,该 物质为易溶于水的强电解质,遇烧碱会生成N4气体,该反应的离子
物质为易溶于水的强电解质,遇烧碱会生成N4气体,该反应的离子 方程式:;另一含氮化合物N4H4也是易溶于水的强电解质,和烧碱
方程式:;另一含氮化合物N4H4也是易溶于水的强电解质,和烧碱 反应生成能使湿润的红色石蕊试纸变蓝的气体,而与盐酸反应生成的产物之一具有极强烈的爆炸性,写出该产物爆炸的化学反应方程式:。
反应生成能使湿润的红色石蕊试纸变蓝的气体,而与盐酸反应生成的产物之一具有极强烈的爆炸性,写出该产物爆炸的化学反应方程式:。
在Fe(OH)3胶体中,逐滴加入HI稀溶液,会出现一系列变化.
(1)先出现红褐色沉淀,原因是__________________________________.
(2)随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式____________________________.
(3)最后溶液颜色加深,此原因的反应 的离子方程式是________________________
的离子方程式是________________________