氧化还原反应的实质是
| A.氧元素的得失 | B.化合价的升降 |
| C.电子转移(得失或偏移) | D.分子中原子重新组合 |
下列无色澄清的溶液中,可能大量共存的离子组是( )
A.[Ag(NH3)2]+、K+、OH-、 |
B.Fe3+、 、Cl-、I- 、Cl-、I- |
C.H+、Al3+、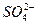 、F- 、F- |
D.ClO-、Na+、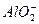 、S2- 、S2- |
向Ba(OH)2溶液中逐滴滴入稀硫酸,下列溶液的导电能力描述正确的是( )
| A.开始时导电能力肯定最强 | B.当沉淀为最大值时,导电性最弱 |
| C.先变强,后变弱 | D.逐渐变弱 |
有下列几种粒子:OH-、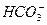 、H+、
、H+、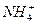 、NH3,其中能在水溶液中两两发生反应的共有( )
、NH3,其中能在水溶液中两两发生反应的共有( )
| A.三组 | B.四组 | C.五组 | D.六组 |
下列各组中的离子能在溶液中大量共存的是()
A.Fe3+、Na+、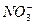 、OH- 、OH- |
B.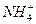 、Fe3+、 、Fe3+、 、 、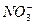 |
C. 、Cl-、Ca2+、Mg2+ 、Cl-、Ca2+、Mg2+ |
D.Ba2+、K+、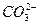 、Cl- 、Cl- |
写出下列反应的离子方程式:
(1)碳酸钙和盐酸反应
(2)氢氧化钠溶液和醋酸(CH3COOH)溶液反应
(3)锌和硫酸铜溶液反应
(4)氢氧化钡溶液和硫酸溶液反应