在密闭容器中一定量混合气体发生反应:
x A (g) + y B(g)  z C(g)
z C(g)
平衡时测得A的浓度为 0.5 mol·L-1,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得 A的浓度为 0.2mol·L-1,下列判断正确的是
A的浓度为 0.2mol·L-1,下列判断正确的是
| A.平衡向正反应方向移动 | B.x+y >z |
| C.C的体积分数保持不变 | D.B的转化率降低 |
天然橡胶是一种以聚异戊二烯为主要成分的天然高分子化合物,由异戊二烯人工合成的一种橡胶最接近天然橡胶,异戊二烯结构简式为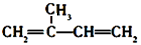 ,下列说法错误的是
,下列说法错误的是
| A.异戊二烯是乙烯的同系物 |
| B.异戊二烯分子中5个碳原子可能共平面 |
| C.异戊二烯与溴1:1加成可得3种产物(不考虑立体异构) |
| D.聚异戊二烯含有碳碳双键,能发生加成反应 |
下列有关实验叙述错误的是
| A.实验室可用硫酸铜溶液除去乙炔中的H2S等杂质气体 |
| B.苯和溴水在溴化铁溶液催化作用下发生取代反应生成溴苯 |
| C.只用溴水就可以将苯、四氯化碳、酒精、氢氧化钠溶液这四种物质区别开 |
| D.将铜丝在酒精灯上加热变黑后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
除去下列物质中的杂质(括号内的物质),所使用的试剂和主要方法都正确的是
| 选项 |
物质 |
使用的试剂 |
主要方法 |
| A |
乙醇(水) |
钠 |
蒸馏 |
| B |
溴苯(溴) |
苯 |
萃取、分液 |
| C |
苯甲酸(KCl) |
水 |
重结晶 |
| D |
乙烷(乙烯) |
氢气 |
反应转化 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.1 mol丙烷中共用电子对数为10NA |
| B.17 g羟基(-OH)所含有的电子数为10NA |
| C.标准状况下,2.24L CHCl3含有的分子数为0.1NA |
| D.常温常压下,7.0 g乙烯与丙烯的混合气体完全燃烧消耗1.5mol氧气 |
下列关于甲烷的叙述中错误的是
| A.甲烷分子具有正四面体结构,两个碳氢键之间的夹角为109°28′ |
| B.甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子 |
| C.甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业 |
| D.“抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸 |