小明同学在某化工厂进行社会实践,技术员与小明一起分析由氯化钙和氯化钠组成的产品中氯化钠的含量。现取13.4g固体样品,全部溶于96.6g水中,向所得的混合溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录了如图所示的曲线关系。技术员提示小明:氯化钙与碳酸钠反应的化学方程式:CaCl2+Na2CO3 =CaCO3↓+2NaCl。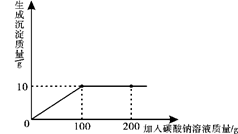
求:(1)当氯化钙与碳酸钠恰好完全反应时,消耗10.6%的碳酸钠溶液的质量是 g。
(2)样品中氯化钠的质量是多少?
(3)当氯化钙与碳酸钠恰好完全反应时,过滤,所得溶液中溶质的质量分数是多少?
课本中有这样一段话:“油脂在人体内完全氧化时,每克放出39.3 kJ的能量,在正常情况下,每日需摄入50 g~60 g油脂,它供给人体日需能量的20%~25%。”按每日摄入50 g油脂,它供给人体日需能量的20%计算,通常情况下,人体每天需要多少能量?
某1 g含有杂质的氢氧化钠样品溶于水能与5 g质量分数为14.6%的盐酸恰好完全反应,计算该样品中氢氧化钠的质量分数。(杂质不与盐酸反应)
4 g某正三价金属R的氧化物与21 g稀硫酸恰好完全反应,反应后所得溶液的溶质的质量分数为40%,计算:
(1)R的相对原子质量。
(2)稀硫酸的溶质质量分数。
注射用链霉素试验针的药液配制方法如下:
(1)把1.0 g链霉素溶于水制成4.0 mL溶液a;
(2)取0.1 mL溶液a,加水稀释至1.0 mL,得溶液b;
(3)取0.1 mL溶液b,加水稀释至1.0 mL,得溶液c;
(4)取0.2 mL溶液c,加水稀释至1.0 mL,得溶液d,
由于在整个配制过程中,药液很稀,其密度可近似看做是1 g/cm3.试求:
(1)最终得到的试验针药液(溶液d)中溶质的质量分数.
(2)1.0 g链霉素可配制多少毫升试验针药液?
某食品加工厂生产的酱油中氯化钠的质量分数为15%~18%,该厂日产酱油15 t.试计算该厂每月(按30天计)消耗多少吨氯化钠