(Ⅰ)现有下列物质: ①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡 ⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液
请用以上物质回答下列问题。(填序号)
(1)在上述状态下能导电的物质是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质,但溶于水后的水溶液能导电的是 ;
(Ⅱ)
某化学实验小组探究市售食用白醋中醋酸的的准确浓度,取25.00mL某品牌食用白
醋于锥形瓶中,在实验室用浓度为cb mol/L的标准NaOH溶液对其进行滴定。
(1)左图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,
A处的刻度为25,滴定管中液面读数应为 mL。
(2)为了减小实验误差,该同学一共进行了三次实验,假设每次
所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实
验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗NaOH溶液体积/mL |
26.02 |
25.35 |
25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,
其原因可能是 。
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
C.第一次滴定用的锥形瓶未润洗
D.滴定结束时,俯视读数
(3)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):
c= 。
(Ⅲ)
已知:在25时H2O H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH  H++ CH3COO- Ka=1.8×10-5
H++ CH3COO- Ka=1.8×10-5
(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H+)与C(CH3COOH)
的比值 (填“增大”或“减小”或“不变”)
(2)醋酸钠水解的离子方程式为 。当升高温度时,C(OH—)将
(填“增大”“减小”“不变”);
(3)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠
的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系
为 ,a与b的关系为 (填“大于”“小于”“等于”);
(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是 。
(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na+)_______________ c(CH3COO-)(填“大于”、“小于”或“等于”),
(6)若由pH=3的HA溶液V1mL与pH=11的NaOH{溶液V2 mL。混合而得,则下列说法不正确的是____________。
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(7)在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol·L-1。向其中加入固
体醋酸钠后测得溶液的C(OH-)为2.2×10-5mol·L-1,以上三种金属离子中
能生成沉淀,原因是
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14)
(8)取10mL0.5mol·L-1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H+)
= 。
(6分,每空3分)从NO3-、SO42-、H+、Cu2+、Ba2+、Ag+、Cl-等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。若两极分别放出气体,且体积比为1∶1,电解质的化学式可能是。
(16分,每空2分)(1)已知丙酮[ CH3COCH3 ]键线式可表示为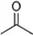 根据键线式回答下列问题:
根据键线式回答下列问题: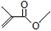 分子式:,结构简式:
分子式:,结构简式:
(2)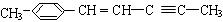 分子中最多有个原子共直线;最多有个原子共平面
分子中最多有个原子共直线;最多有个原子共平面
(3)有机物CH3CH(C2H5)CH(CH3)2的名称是
(4)写出由苯丙烯(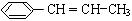 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式:
(5)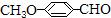 有多种的同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是:、、(任写其中二种)
有多种的同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是:、、(任写其中二种)
将6.4 g铜加入到50 mL a mol/L的硝酸溶液中,铜全部溶解,得到NO2和NO的混合气体。将反应后溶液稀释至100 mL,测得NO3-的浓度为3 mol/L。
(1)混合气体中NO2和NO的总物质的量为 mol(用含a的式子表示)。
(2)稀释后的溶液中H+的物质的量浓度为 mol/L。
(3)若a=9,则混合气体中NO2的物质的量为 mol。
氯化铵是一种重要的化工原料,应用广泛。
(1)实验室通常用NH4Cl固体与Ca(OH)2固体混合共热制取氨气。
①写出实验室制取氨气的反应方程式 。
②浓氨水可以用来检验有毒气体氯气的泄漏,反应式为3Cl2 +8NH3= N2 + 6NH4Cl,在该反应中,氧化剂是 (填化学式),检测时观察到的现象是 ,21.3 g氯气能氧化氨气mol。
(2)用浓氯化铵溶液处理的舞台幕布难着火,其原因是(填字母)。
①幕布的着火点升高
②幕布的质量增加
③氯化铵分解吸收热量,降低了温度
④氯化铵分解产生的气体隔离了部分空气
| A.①② | B.③④ | C.①③ | D.②④ |
(3)实验室可用NH4Cl溶液与饱和的NaNO2溶液反应制取纯净的氮气,反应方程式为:
NaNO2+NH4Cl 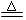 NaCl+N2↑+2H2O
NaCl+N2↑+2H2O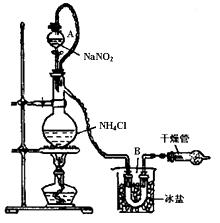
实验装置如下图所示,试回答:
①装置中A部分的分液漏斗与蒸馏烧瓶之间连接
的导管所起的作用是(填写编号)。
a.防止饱和溶液蒸发
b.保证实验装置不漏气
c.使饱和NaNO2溶液容易滴下
②加热前必须进行的一个操作步骤是 。
③收集N2最适宜的方法是(填写编号)
a.排空气法收集在集气瓶中
b.排水法收集在集气瓶中
c.直接收集在球胆或塑料袋中
化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等都离不开化学。
(1)硅是无机非金属材料的主角。请你举出两种含硅的材料名称 ;铝制品表面有一层氧化铝薄膜而经久耐用,但该氧化膜易被酸、碱破坏。若将氧化铝与氢氧化钠溶液作用,反应的离子方程式为 。
(2)氯气用于漂白时,实际上起漂白作用的物质不是Cl2而是它和水反应生成的
(写化学式)。缺铁性贫血患者补充的Fe2+,通常以硫酸亚铁的形式,而硫酸铁则没有这种药效。当用硫酸亚铁制成药片时外表要包有一层特殊的糖衣,这层糖衣的作用是 。
(3)从降低成本和减少环境污染的角度考虑,制取硝酸铜最好的方法是(填代号)。
| A.铜和浓硝酸反应 | B.铜和稀硝酸反应 |
| C.氧化铜和硝酸反应 | D.铜先与浓硫酸共热,再加入硝酸钡 |