目前,在研究新能源的前沿技术上,科学家致力于二氧化碳的“组合转化”技术的研究,把过多的二氧化碳转化为有益于人类的物质。
(1)乙烯的产量是衡量一个国家石油化工发展水平的标志之一,下列石油化工生产能提高乙烯的产量的是________。
A.蒸馏、分馏 B.催化裂化
C.催化裂解 D.催化重整
(2)下列说法不正确的是__________。
A.石油是混合物,分馏后得到的馏分是纯净物
B.煤隔绝空气加强热可以得到黑褐色油状的煤焦油
C.煤的气化和液化是使煤变成清洁能源的有效途径
D.从绿色化学角度考虑,以植物为主的生物质资源,是未来的理想资源
(3)如果将CO2和H2以1∶4的比例混合,通入反应器,在适当的条件下反应,可获得一种重要的能源。请完成以下化学方程式:
CO2+4H2―→(__________)+2H2O
(4)若将CO2和H2以1∶3的比例混合,使之发生反应生成某种重要的化工原料和水,该原料可能是________。
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
(5)甲、乙、丙三个化肥厂生产尿素所用的原料不同,但生产流程相同:
原料—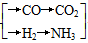 →CO(NH2)2
→CO(NH2)2
①甲厂以焦炭和水为原料;②乙厂以天然气和水为原料;③丙厂以石脑油(主要成分为C5H12)和水为原料。按工业有关规定,利用原料所制得的原料气H2和CO2的物质的量之比,若最接近合成尿素的原料气NH3(换算成H2的物质的量)和CO2的物质的量之比,则对原料的利用率最高。据此判断甲、乙、丙三个工厂哪个工厂对原料的利用率最高?________。
(6)请根据以上信息,设计工业合成尿素的条件_________________________。
M为一种常见的液体试剂。下列物质在一定条件下可发生如下图所示的转化关系。
回答下列问题:
⑴写出淡黄色粉末和M反应的化学方程式
⑵若固体乙是硫化铝,则:
①C化学式是,G的化学式是;
②H溶解于A溶液的离子方程式是;
⑶若白色沉淀D不能溶解于A溶液,气体C能使湿润的试纸变蓝,则固体乙的化学式可能是
现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种分子中含有相同数目质子的化合物,C和D结合生成化合物丁。B、C两种元素的单质和甲、乙、丙、丁四种化合物的转化关系如图:
⑴根据以上条件,可以确定A、B、C、D四种元素中三种,不能被确定的第四种元素是 ,
写出转化关系图中已确认的反应的化学方程式:
⑵以下四个补充条件中的任何一个都可以进一步确定第四种元素,但其中一个条件推断出的第四种元素与其余三个条件推断出的第四种元素不同,这个条件是 ;
A.化合物甲与丙、乙与丙均能够发生反应 B.化合物甲、乙、丙都是无色物质,其中只有甲有刺激性气味 C.通常情况下乙和丁不发生反应,若将乙、丁、单质C混合,立即发生化合反应。
|
D.单质C和化合物丁不能共存。
依据该条件推断,第四种元素在周期表中的位置为 ;1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定F的电负性为4,并通过热化学方法建立了其他元素的电负性。Linus Pauling建立的主族元素的电负性如下:
| H:2.1 |
||||||
| Li:1.0 |
Be:1.5 |
B:2.0 |
C:2.5 |
N:3.0 |
O:3.5 |
F:4.0 |
| Na:0.9 |
Mg:1.2 |
Al:1.5 |
Si:1.8 |
P:2.1 |
S:2.5 |
Cl:3.0 |
| K:0.8 |
Ca:1.0 |
Ga:1.6 |
Ge:1.8 |
As:2.0 |
Se:2.4 |
Br:2.8 |
| Rb:0.8 |
Sr:1.0 |
In:1.7 |
Sn:1.8 |
Sb:1.9 |
Te:χ |
I:2.5 |
| Cs:0.7 |
Ba:0.9 |
Tl:1.8 |
Pb:1.9 |
Bi:1.9 |
Po:2.0 |
At:2.2 |
| Fr:0.7 |
Ra:0.9 |
回答下列问题:
⑴纵观各周期主族元素电负性变化,谈谈你对元素性质呈现周期性变化的理解:;
⑵预测Te元素χ的值;
⑶你认为Linus Pauling提出电负性的概念是确定化合物中原子哪种能力的相对大小?;
⑷大量事实表明,当两种元素的电负性差值小于1.7时,这两种元素通常形成共价化合物。用电子式表示AlBr3的形成过程。
(本题共13分)以下两个化学实验是某小组的同学对海水中化学资源的探究活动。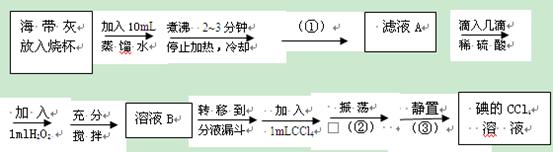
(一)从海带灰中提取碘
从海带灰中提取碘的实验流程如下:
(1)实验流程中,括号里①②③表示的是操作方法,请填写:
①②③
(2) 实验流程中,“煮沸2~3分钟”主要作用是。
(3)实验流程中,“滴加稀硫酸和加入H2O2”主要作用是______________。
(二) 测定卤水中硫酸镁的含量
用海水制盐,分离出食盐后的卤水,主要含有氯化钠和硫酸镁。测定卤水中硫酸镁含量的实验步骤如下:
①量取该卤水样品100mL。
②取用一定物质的量浓度的氢氧化钠溶液100mL,平均分四次依次加入到该100mL卤水样品中,充分振荡。
③每次实验所得数据见下表
 |
1 |
2 |
3 |
4 |
| 加入氢氧化钠溶液的体积/mL |
25 |
25 |
25 |
25 |
| 生成沉淀的总质量/g |
0.29 |
X |
0.87 |
0.87 |
请回答
(4)请写出实验过程中所涉及到的反应离子方程式____________________。
(5)上表中X是因为实验过程中漏记了数值,你推测X的数值为_____。
(6)实验中所用到的氢氧化钠溶液物质的量浓度为_______________。
(7)100mL卤水中含硫酸镁的质量是_________g
(本题共9分)化学能在一定的条件下可以转化为电能。
(一)现有如下两个反应:
① 2FeCl3 + Cu = 2FeCl2 + CuCl2
② Na2CO3 + 2HCl =" 2NaCl" + H2O + CO2↑
(1)根据两个反应的本质判断,您认为可以设计成原电池的是(填反应序号),理由是。
(二)请根据Zn + CuSO4 = ZnSO4 + Cu反应,选择适宜的材料和试剂设计一个原电池。
(2)画出原电池装置图,并在图中标注出电极和电解质溶液的名称。
(3)写出该原电池电极反应式:正极:;负极:。