(9分) 通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是________________;
(2)由粮食发酵获得X的化学变化过程中,最主要的两个化学方程式是:
______________________ ,__________________________________ ;
(3)实验室可用X制取乙烯,该反应类型为 ______________ .
将6 mol H2和3 mol CO充入容积为0.5 L的密闭容器中,进行如下反应:2 H2(气) + CO(气) 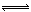 CH3OH(气),6秒时体系达到平衡,此时容器内气体的物质的量为开始时的0.6倍,求(1)H2的反应速率;
CH3OH(气),6秒时体系达到平衡,此时容器内气体的物质的量为开始时的0.6倍,求(1)H2的反应速率;
(2)CO的转化率;
(3)求相同条件下CH3OH(气) 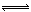 2 H2(气) + CO(气)的平衡常数K
2 H2(气) + CO(气)的平衡常数K
下图是某工厂生产甲醇(CH3OH)的工艺流程图: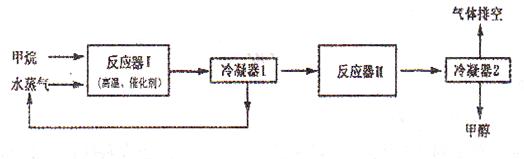
已知,在反应器II中CO在高温、高压、催化剂存在的条件下跟H2充分反应后,仍剩余1/3。请回答下列问题:
(1)在反应器I中,发生反应的化学方程式是_______________________ _____________。
_____________。
(2)从提高原子的利用率出发,该生产工艺需要进行的改进是_____________________。
(3)右图表示CO和H2反应合成甲醇过程中的能量变化,曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂时反应的能量变化。则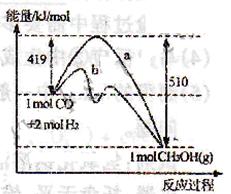
①反应的热化学方程式为___________________________________________。
②在恒容条件下,能使该反应的平衡常数改变的措施有_________________。(填字母)
| A.加压 |
| B.降低温度 |
| C.再充入1mol CO和2molH2 |
| D.使用更高效的催化剂。 |
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)今有如下两个热化学方程式:则ab(填>, =" ," <)
H2(g)+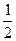 O2(g) = H2O(g) ΔH1=a kJ·mol-1
O2(g) = H2O(g) ΔH1=a kJ·mol-1
H2(g)+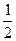 O2(g) = H2O(l)ΔH2=b kJ·mol-1
O2(g) = H2O(l)ΔH2=b kJ·mol-1
(2)由气态基态原子形成1mol化学键释放 的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 |
H-H |
N-H |
N≡N |
| 键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2(g)+3H2(g)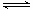 2NH3(g)△H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:_______________。
2NH3(g)△H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:_______________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。
已知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s)和H2(g)生成1mol C2H2(g)反应的反应热
△H =____________________ __。
__。
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(As为砷元素)
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成1 mol X,则X的化学式为________。
(3)根据上述反应可推知________。
a.氧化性:KBrO3>H3AsO4 b.H3ASO4是还原产物
c.还原性:AsH3>X d.K2SO4和H2O是还原产物
(4)请将反应物的化学式和配平后的系数填入下列相应的位置中,并用“单线桥”标出电子转移的方向和数目。
某无色溶液,由Na+、Ba2+、Al3+、Cl-、MnO4-、CO32-、NO3-中的若干种组成。,现取两份100 mL溶液进行 如下实验:
如下实验:
① 第一份小心蒸发得溶质3.08g;
② 第二份加足量AgNO3溶液后,得干燥沉淀5.63g,向沉淀中加入足量盐酸,生成标准状况下气体0.224L。
根据上述实验回答下列问题:
(1)第二份溶液所得沉淀的成分是 ,其物质的量分别是 。
(2)写出步骤②中所发生的所有反应的离子方程式
。
(3)一定存在的离子是 ,其浓度分别是 。