现有以下实验装置供实验时挑选使用。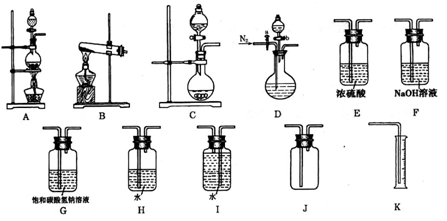
(1)利用Cu和浓硝酸反应制备NO2,用过氧化氢溶液和MnO2制取O2,根据反应原理应选用___________装置(填序号,从A、B、C中选取)。
(2)某同学设计下列四种制备NH3的方法,不合理的是_________(填序号)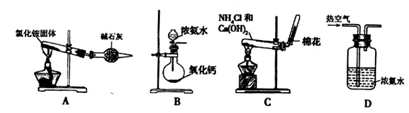
(3)欲用石灰石和浓盐酸反应制取纯净干燥的CO2气体,将你所选的仪器按气体由左向右方向连接,连接顺序为______________→G→___________________。
用饱和碳酸氢钠溶液除去挥发出的HCl优于用水除HCl的原因是_____________________
____________________________________________________。
(4)某小组为了探究Ag与浓硝酸反应过程中可能产生NO,设计了一连接顺序为D→H→I→K的实验装置。
①检验这一装置气密性的方法是________________________________________________
__________________________________________________________________________,
②反应开始前通入N2的目的是______________________________________________,
③反应结束,若H瓶中溶液体积为100mL,从中取出25.00mL溶液以酚酞作指示剂,用0.1000mol·L—1NaOH溶液进行滴定,两次滴定用去NaOH溶液的体积分别为16.98mL和17.0.2mL,则该瓶中硝酸的物质的量浓度为_________________。
若实验测得NO的体积为95.2mL(已折算成标准状况),请你通过数据说明Ag与浓硝酸反应过程中是否有NO产生____________________________________________________
___________________________________________________________________________。
、
、
、
为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,
有5个原子核。通常状况下,
为无色液体。
已知:
+
 +
(1)
的电子式是。
+
(1)
的电子式是。
(2)液态
和
的电离相似,都可电离出电子数相同的两种离子,液态
的电离方程式是。
(3)用图示装置制备
并验证其还原性。有下列主要操作

a.向广口瓶内注入足量热
溶液,将盛有铜片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤
后还缺少的一步主要操作是。
②红磷充分燃烧的产物与
溶液反应的离子方程式是。
③步骤
滴入稀硝酸后烧杯中的现象是。
反应的离子方程式是。
(4)一定温度下,将1
置于密闭容器中,保持压强不变,升高温度至
的过程中,气体由无色逐渐变为红棕色。温度由
继续升高到
的过程中,气体逐渐变为无色。若保持
,增大压强,气体逐渐变为红棕色。气体的物质的量
随温度
变化的关系如图所示

①温度在
-
之间,反应的化学方程式是。
②温度在
-
之间,气体的平均相对分子质量是(保留1位小数)。
.已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O====K2SO4+2MnSO4+2H2SO4。
(1)浓硫酸与木炭在加热条件下反应的化学方程式是_____________________。
(2)试用下图所列各种装置设计一个实验,来验证上述反应所产生的各种产物。这些装置的连接顺序(按产生气体从左到右的方向)是_________ _________
_________ _________
_________ _________。(填装置的编号)
_________。(填装置的编号)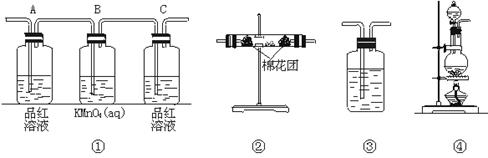
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是_______________,B瓶溶液的作用是______________________,C瓶溶液的作用是_______________。
(4)装置②所加的固体药品是_______________,可验证的产物是_______________,确立装置在整套装置中位置的理由是_______________。
(5)装置③中所盛溶液是_______________,可验证的产物是_______________
有甲、乙两位同学根据所学化学知识,设计了由铜和硫酸为原料制取硫酸铜的两种方案:①铜与浓硫酸直接反应,即Cu CuSO4。②由Cu
CuSO4。②由Cu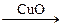 CuSO4,试回答:
CuSO4,试回答:
(1)写出有关的化学反应方程式_______________、_______________、___________。
(2)这两种方案,你认为哪一种方案较合理?
(3)请说明选择合理方案的理由。
除去下列物质中的杂质,根据需要填空。(每空1分,共8分)
| 物质 |
杂质 |
选用试剂 |
离子方程式 |
| NaCl |
Na2SO4 |
||
| KCl |
K2CO3 |
||
| NaCl |
MgCl2 |
||
| Na2SO4 |
NaHSO4 |
一种溶液里可能含有OH-、Cl-、CO 、SO
、SO 四种离子中的一种或几种。取少量这种溶液分别盛于三支试管中,进行如下实验:
四种离子中的一种或几种。取少量这种溶液分别盛于三支试管中,进行如下实验:
(1)向第一支试管中滴入酚酞试液,溶液变红。
(2)向第二支试管中加入Ba(NO3)2溶液,有白色沉淀生成。
(3)向第三支试管中逐滴加入稀HNO3溶液,有无色气体生成,该气体能使澄清石灰水变浑浊;继续加入稀HNO3使溶液呈酸性时,再加入Ba(NO3)2溶液不产生沉淀。
试判断:该溶液中肯定含有___________离子,肯定没有___________离子,不能肯定有没有的是_________离子。(每空2分,共6分)