、、、为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,有5个原子核。通常状况下,为无色液体。
已知:+ +(1)的电子式是。
+(1)的电子式是。
(2)液态和的电离相似,都可电离出电子数相同的两种离子,液态的电离方程式是。
(3)用图示装置制备并验证其还原性。有下列主要操作

a.向广口瓶内注入足量热溶液,将盛有铜片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤后还缺少的一步主要操作是。
②红磷充分燃烧的产物与溶液反应的离子方程式是。
③步骤滴入稀硝酸后烧杯中的现象是。
反应的离子方程式是。
(4)一定温度下,将1置于密闭容器中,保持压强不变,升高温度至的过程中,气体由无色逐渐变为红棕色。温度由继续升高到的过程中,气体逐渐变为无色。若保持,增大压强,气体逐渐变为红棕色。气体的物质的量随温度变化的关系如图所示

①温度在-之间,反应的化学方程式是。
②温度在-之间,气体的平均相对分子质量是(保留1位小数)。
硫代硫酸钠(Na2S2O3)俗称大苏打,照相业中用作定影剂。Na2S2O3易溶于水,在酸性溶液中与酸反应有单质硫和SO2生成。
(1)Na2S2O3溶液与稀硫酸混合反应可用于探究外界条件对反应速率的影响,完成有关的实验设计表(已知各溶液体积均为5 mL):
| 实验编号 |
T/K |
c(Na2S2O3)/ mol·L-1 |
c(H2SO4)/ mol·L-1 |
实验目的 |
| ① |
298 |
0.1 |
0.1 |
实验①和②探究温度对该反应速率的影响; 实验①和③探究反应物浓度对该反应速率的影响 |
| ② |
308 |
|||
| ③ |
0.2 |
(2)Na2S2O3还具有很强的还原性,Na2S2O3溶液与足量氯水反应的化学方程式为:
________(提示:S元素被氧化为SO42-)。
(3)现有一瓶Na2S2O3固体,可能含有Na2SO4固体,请设计实验验证,写出实验步骤、预期现象和结论。限选试剂:1 mol·L-1 H2SO4、1 mol·L-1 HNO3、1 mol·L-1 HCl、1 mol·L-1 NaOH、0.1 mol·L-1 Ba(NO3)2、0.1 mol·L-1 BaCl2、0.01 mol·L-1 KMnO4、蒸馏水。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量固体于试管A中,加蒸馏水溶解。 |
|
| 步骤2:向试管A加入 |
|
| 步骤3:取步骤2的少量上层清液于试管B中, |
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下: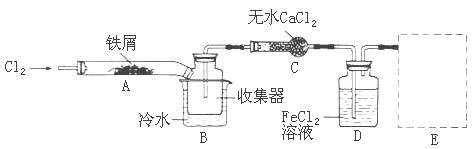
①检查装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成
④ ……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封
请回答下列问题:
(1)写出FeCl3溶液吸收有毒的H2S的离子方程式为
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。要使沉积得FeCl3进入收集器,第④步操作是
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)
(4)装置B中的冷水作用为;装置C的名称为;装置D中FeCl2全部反应完后,因为失去吸收Cl2的作用而失效,从下面选出检验FeCl2是否完全失效的试剂:___
| A.氢氧化钠溶液 | B.酸性高锰酸钾溶液 | C.硫氰化钾溶液 | D.氨水 |
(5)在虚线框内画出尾气吸收装置E并注明试剂。
某研究小组模拟工业处理电镀含氰废水并测定处理的效率,利用下图所示装置进行实验。将CN-的浓度为0.2 mol·L-1的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②三颈烧瓶中,充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。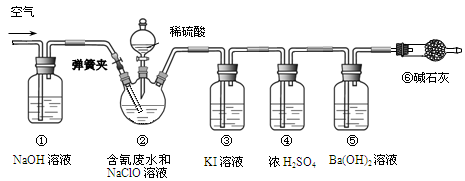
已知装置②中发生的主要反应依次为:CN-+ ClO-=CNO-+ Cl- 2CNO-+2H+ +3C1O-=N2↑+2CO2↑+3C1-+H2O
(1)①和⑥的作用是。
(2)装置②中,生成需由装置③除去的物质的离子方程式为。
(3)反应结束后,缓缓通入空气的目的是。
(4)为计算该实验中含氰废水被处理的百分率,需要测定的质量。
(5)已知CN-的处理效率可高达90%,产生的CO2在标准状况下的体积为。
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图1、2所示的实验。请回答相关问题。
(1)定性分析:如图1可通过观察,定性比较得出结论。有同学提出将FeCl3改为0.05 mol/L Fe2(SO4)3更为合理,其理由是。
(2)定量分析:如图2所示,实验时均生成40 mL气体,其它可能影响实验的因素均已忽略。实验中需要测量的数据是。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示。
①写出H2O2在二氧化锰作用下发生反应的化学方程式。
②实验时放出气体的总体积是mL。
③A、B、C、D各点反应速率快慢的顺序为:>>>。
解释反应速率变化的原因。
④H2O2的初始物质的量浓度是(请保留两位有效数字)。
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花。给试管加热,观察现象。反应一段时间后,停止加热。回答下列问题: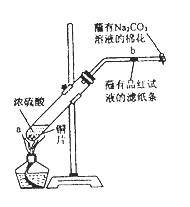
(1)写出a处反应的化学方程式。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为。待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为。
(3)待试管中的液体冷却后,将试管上层液体倒去,再将剩余物质慢慢加入水中,可观察溶液呈色。
(4)玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花所起的作用是,反应的化学方程式为。
(5)若用浓度为18 mol/L的浓硫酸100 mL与过量的铜片,加热使之反应,则被还原的硫酸(选填“大于”、“等于”或“小于”)0.9 mol 。