(本题共12分)
某化学课外小组设计了如下图所示的装置进行实验。图中箭头表示气体流向。A表示一种纯净、干燥的气体,B是另一种气体,反应进行一段时间后,装置己中有红棕色气体生成。实验中所用的药品和干燥剂只能从下列物质中选取:Na2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2 、NH4HCO3、碱石灰等固体和蒸馏水。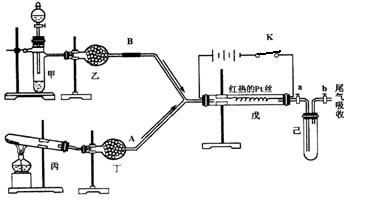
根据图中装置和反应现象请回答:
(1)丙中发生反应的化学方程式为 。
(2)丁中的干燥剂应选 ________,不选另一种干燥剂的由 。
(3)甲中发生反应的化学方程式为 。
(4)戊中发生的主要反应的化学方程式为____________________,此反应是________(吸热、放热)反应,能证明你的判断的现象是 。
(5)当己中充满红棕色气体后,停止给丙加热,并关闭a、b两个活塞,若将己浸入冰水中,则已中会出现的现象是:______________,产生此现象的原因: 。
下表是稀硫酸与某金属反应的实验数据:
| 实验序号 |
金属 质量/g |
金属状态 |
c(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失的时间/s |
|
| 反应前 |
反应后 |
||||||
| 1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
| 2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
| 3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
| 4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
| 5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
| 6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
| 7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
| 8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
| 9 |
0.10 |
丝 |
1.1 |
50 |
30 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,_________对反应速率有影响,_________反应速率越快,能表明同一规律的实验还有_________(填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有_________(填实验序号);
(3)本实验中影响反应速率的其他因素还有_________,其实验序号是_________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
____________________________________。
实验室用下图装置制取少量溴苯,试填写下列空白。
(1).在烧瓶a中装的试剂是、、。
(2).请你推测长直导管b的作用: ___________ 。
(3).请你分析导管c的下口不能浸没于液面中的原因是
。
(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有褐色难溶于水的液体,简述获得纯净的溴苯应进行的实验操作:____________________________。
我校某化学小组欲设计实验检验浓H2SO4和木炭反应的所有产物:
(1)写出浓H2SO4和木炭反应的化学方程式
(2)请你从下图中选用所需的仪器(可重复使用)组成一套装置帮助该小组实现他们的目的.现提供浓H2SO4、木炭和酸性KMnO4溶液,无水硫酸铜,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
将所选的仪器按连接顺序由上至下依次填入下表(可以不填满,也可以补充),并写出该仪器中应加试剂的名称及其作用。
| 选用的仪器 (填字母) |
加入的试剂 |
作用 |
| (1) |
无水硫酸铜 |
|
| (2) A |
||
| (3) |
酸性KMnO4溶液 |
|
| (4) |
检验SO2是否已除尽 |
|
| (5) A |
(10分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用带刻度的集气瓶排水法收集氢气,每隔1分钟记录一次数据(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)从0~3分钟时间段内,产生氢气的速率是如何变化的?答:___________________,造成这种变化的主要因素是____________;从3~5分钟时间段内,产生氢气的速率是如何变化的?
答:_________________,造成这种变化的主要因素是_________________。
(2)在盐酸中分别加入等体积的下列溶液,能减缓反应速率而又不减少产生氢气的量的是__________(双选题,漏选得1分,多选错选得0分)。
A.蒸馏水 B.CuSO4溶液 C.Na2CO3溶液 D.NaCl溶液
(3)在0~1、1~2、2~3、3~4、4~5分钟五个时间段中,反应速率最大的是在分钟时间段内,在该时间段内盐酸的反应速率为mol·L-1 min-1(设溶液体积不变,上述气体体积为标况下数据)。
Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。
请你评价若用上述方法制取乙醛存在哪些不足:
_____________________________________________________________________
Ⅱ.课外活动小组甲,自行设计了下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去。请回答下列问题:
(1)实验前,首先检查装置的气密性,然后分别向试管A中加入乙醇,C中加入水;
(2)实验时,先加热B装置中的玻璃管,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
①乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为______________________________________________________;
②通入空气的速度过快或过慢都不利于反应的进行,控制气体流速的实验操作现象是:________________________________________________________;
Ⅲ.课外活动小组乙,在研究了课外活动小组甲的方案后,认为该方案中有不足和不安全的地方。
(3)课外活动小组乙对甲的方案提出改进意见:
①将A装置浸在70~80℃的水浴中,目的是____________________________;
②装置B、C之间接上D装置,请你在上面方框中,画出D的装置图。
(4)如果在装置B、C之间不增加D装置,提出你对实验改进的意见:
。