四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意图如下: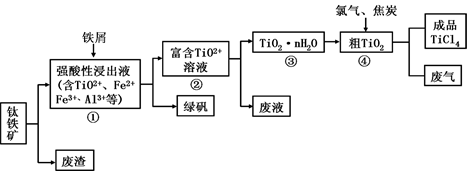
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3+ + Fe ="===" 3Fe2+
2 TiO2+(无色)+ Fe + 4H+="===" 2Ti3+(紫色)+ Fe2++2 H2O
Ti3+(紫色)+ Fe3++ H2O ====TiO2+(无色)+ Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在
范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25°C时,Ksp[Fe(OH)3] =2.79×10-39,该温度下反应Fe(OH)3+3H+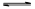 Fe3++3H2O的平衡常数K= 。
Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)====TiCl 4(l)+O2(g) ΔH=+140kJ·mol-1
2C(s)+O2(g)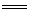 2CO(g) △H=-221kJ·mol-1
2CO(g) △H=-221kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl 4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项 )。
(6)依据表格信息,要精制含少量SiCl 4杂质的TiCl 4,可采用 方法。
| |
TiCl4 |
SiCl4 |
| 熔点/℃ |
-25.0 |
-68.8 |
| 沸点/℃ |
136.4 |
57.6 |
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的浓度, 请填写下列空白:
(1)将10.00 mL过氧化氢溶液移至250mL (填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数分别填在下列横线和括号内。
MnO4- + H2O2 + H+ = Mn2+ + O2 + H2O
(3)KMnO4标准液装在 滴定管,滴定到达终点的现象是
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的浓度为
(5)若盛装高锰酸钾标准溶液的滴定管用蒸馏水洗后没有用标准液润洗,则测定结果 (填“偏高”或“偏低”或“不变”)。
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g) NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图装置A制取氨气,你所选择的试剂是。
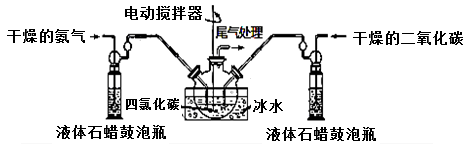
装置A装置B
(2)制备氨基甲酸铵的装置B如上图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是: 、 。液体石蜡鼓泡瓶的作用是: 。
②从反应后的混合物中分离出产品,为了得到干燥产品,应采取的方法是_______(填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干
③尾气处理装置如图所示。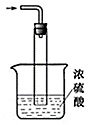
双通玻璃管的作用:;浓硫酸的作用: 、 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品11.73 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为15.00 g。
则样品中氨基甲酸铵的物质的量分数为 _____ 。
某地区的雾霾中含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。
收集该地区的雾霾,经必要的预处理后得试样溶液,取适量该试样溶液进行如下实验:
已知:3NO3-+ 8Al + 5OH-+ 2H2O 3NH3+ 8AlO2-
3NH3+ 8AlO2-
根据以上实验操作与现象,回答下列问题:
(1)气体X的分子式为________________;沉淀1的主要成分是 (填化学式)。
(2)生成沉淀2的离子方程式有两个,分别是 ___、 。
(3)第④步发生反应,每产生5.6 L标准 状况下的气体X,转移电子的物质的量为 。
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下:
①配制100mL 1.0mol•L﹣1的盐酸溶液;
②用 (填仪器名称并注明规格)量取7.5mL 1.0mol•L﹣1的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为 g;
④往广口瓶中装入足量水,按如图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL.
请将上述步骤补充完整并回答下列问题.
(1)步骤①中,配制100mL 1.0mol•L﹣1的盐酸溶液时,下列哪些操作会使配制浓度偏小 (填写字母).
A.用量筒量取浓盐酸时,俯视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓盐酸在烧杯中稀释时,搅拌时间过长
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线,继续加水至刻度线
E.在容量瓶中定容时俯视容量瓶刻度线
F.烧杯中有少量水
(2)请填写操作步骤中的空格:步骤② ,步骤③ g.
(3)实验步骤⑤中应选用 (填字母)的量筒.
A.100mL B.200mL C.500mL
(4)忽略水蒸气影响,在该条件下测得气体摩尔体积的计算式为Vm= L/mol.
(5)若未除去镁条表面的氧化膜,则测得该条件下气体的摩尔体积 (填偏大、偏小或无影响).
掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
(1)写出下列仪器的名称:①__________,②__________,
(2)若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有______________,将仪器补充完整后进行的实验操作的名称为____________;
(3)用Na2CO3·10H2O晶体,配制0.2 mol·L-1的Na2CO3溶液480 mL。
①应称取Na2CO3·10H2O晶体的质量:__________。
②所用仪器除托盘天平、烧杯、玻璃棒、药匙、量筒外,还需要__________(填仪器名称)。
③根据下列操作对所配溶液的浓度产生的影响,完成下列要求:
| A.Na2CO3·10H2O晶体失去了部分结晶水 |
| B.用“左码右物”的称量方法称量晶体(使用游码) |
| C.称量碳酸钠晶体时所用砝码生锈 |
| D.容量瓶未经干燥使用 |
其中引起所配溶液浓度偏高的有___________(填字母)
④装置Ⅱ是某同学转移溶液的示意图,图中的错误是__________________