某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下:

①配制100mL 1.0mol•L﹣1的盐酸溶液;
②用 (填仪器名称并注明规格)量取7.5mL 1.0mol•L﹣1的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为 g;
④往广口瓶中装入足量水,按如图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL.
请将上述步骤补充完整并回答下列问题.
(1)步骤①中,配制100mL 1.0mol•L﹣1的盐酸溶液时,下列哪些操作会使配制浓度偏小 (填写字母).
A.用量筒量取浓盐酸时,俯视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓盐酸在烧杯中稀释时,搅拌时间过长
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线,继续加水至刻度线
E.在容量瓶中定容时俯视容量瓶刻度线
F.烧杯中有少量水
(2)请填写操作步骤中的空格:步骤② ,步骤③ g.
(3)实验步骤⑤中应选用 (填字母)的量筒.
A.100mL B.200mL C.500mL
(4)忽略水蒸气影响,在该条件下测得气体摩尔体积的计算式为Vm= L/mol.
(5)若未除去镁条表面的氧化膜,则测得该条件下气体的摩尔体积 (填偏大、偏小或无影响).
(3分)乙酸是食醋的主要成分,它具有以下化学性质:‘
(1)可使紫色石蕊试液变______色,说明乙酸具有______性。
(2)能发生酯化反应。实验室用右图所示装置制取乙酸乙酯,请写出该反应的化学方程式:。
(6分) 为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如下三套实验装置
(1)实验装置和所用药品都正确的是(填“甲”、“乙”或“丙”)。
(2)写出制取氨气的化学方程式。
(3)如何检验氨气是否收集满(简述操作方法、现象和结论)。
(4)氨是一种重要的化工产品,其化学式为,具有气味,密度比空气。
浓硫酸在实验室可用来干燥Cl2、HCl等气体,这是利用了浓硫酸的__________性。蔗糖遇浓硫酸变黑,是由于浓硫酸具有__________性。若将盛有浓硫酸的容器敞口放在空气中一段时间后, 其质量会__________(填“增加”、“减少”或“没有变化”)。
实验室需要配制O.5 mol·L一的烧碱溶液450ml,根据溶液配制的过程,回答下列问题:
(1)实验中除了托盘天平(带砝码)、药匙、量筒和玻璃棒外,还需要的其他玻 璃仪器有:。
璃仪器有:。
(2)根据计算得知,所需NaOH固体的质量为g 。
。
(3)配制溶液的过程中,有以下操作,其中正确的是(填代号)。
A.将氢氧化钠固体放在纸片上称量
B.在烧杯中溶解氧氧化钠固体后,立即将溶液倒入容量瓶中
C.将溶解氢氧化钠的烧杯用蒸馏水洗涤2~3次,并将洗涤液转移到容量瓶中
(4)玻璃捧在该实验中的作用有:①,②。
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。 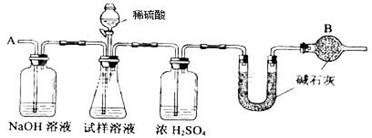
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到b g
④从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明;
(2)装置中干燥管B的作用是 ;
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果(填偏高.偏低或不变);
(4)步骤⑤的目的是 ;
(5)步骤⑦的目的是 ;
(6)该试样中纯碱的质量分数计算式为 。