利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体。
I.实验室制取无色的无水AlBr3(熔点:97.5℃,沸点:263.3℃~265℃,在空气中AlBr3遇水蒸气易发生水解)可用如图所示装置,主要实验步骤如下: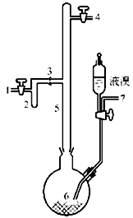
步骤l.将铝箔剪碎,用CCl4浸泡片刻,干燥,然后投入到烧瓶6中。
步骤2.从导管口7导入氮气,同时打开导管口l和4排出空气,一段时间后关闭导管口7和1;导管口4接装有P2O5的干燥管。
步骤3.从滴液漏斗滴入一定量的液溴于烧瓶6中,并保证烧瓶6中铝过剩。
步骤4.加热烧瓶6,回流一定时间。
步骤5.将氮气的流动方向改为从导管口4到导管口l。将装有P2O5的干燥管与导管口1连接,将烧瓶6加热至270℃左右,使AlBr3蒸馏进入收集器2。
步骤6.蒸馏完毕时,在继续通入氮气的情况下,将收集器2从3处拆下,并立即封闭3处。
(1)步骤l中,铝箔用CCl4浸泡的目的是______________________________。
(2)步骤2操作中,通氮气的目的是______________________________。
(3)步骤3中,该实验要保证烧瓶中铝箔过剩,其目的是_______________________。
(4)步骤4依据何种现象判断可以停止回流操作_______________________________。
(5)步骤5需打开导管口l和4,并从4通入N2的目的是_______________________。
II.某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图所示,实验中可选用的试剂:处理过的铝箔;2.0mol·L-1NaOH溶液:2.0 mol·L-1硫酸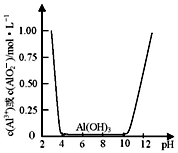
(6)由铝箔制备硫酸铝晶体的实验步骤依次为:
①称取一定质量的铝箔于烧杯中,分次加入2.0 mol•L-1NaOH溶液,加热至不再产生气泡为止。
②过滤
③_________________________________;
④过滤、洗涤沉淀;
⑤向沉淀中不断加入2.0mol·L-1硫酸,至恰好溶解;
⑥_______________;
⑦冷却结晶;
⑧过滤、洗涤、干燥。
实验室制备1,2二溴乙烷的反应原理如下:
CH3CH2OH CH2===CH2CH2===CH2+Br2―→BrCH2CH2Br
CH2===CH2CH2===CH2+Br2―→BrCH2CH2Br
乙醇 1,2二溴乙烷 乙醚
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140 ℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如图所示,有关数据列表如下:
 状态 状态 |
无色液体 |
无色液体 |
无色液体 |
| 密度/g·cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
-130 |
9 |
-116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是_____;(填正确选项前的字母)
a.引发反应b.加快反应速度
c.防止乙醇挥发d.减少副产物乙醚生成
(2)在装置C中应加入________,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a.水b.浓硫酸
c.氢氧化钠溶液d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是_____________________________;
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_______层(填“上”或“下”);
(5)若产物中有少量未反应的Br2,最好用________洗涤除去;(填正确选项前的字母)
a.水b.氢氧化钠溶液
c.碘化钠溶液d.乙醇
(6)若产物中有少量副产物乙醚,可用__________的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是______________________;
但又不能过度冷却(如用冰水),其原因是__________________________________________。
环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮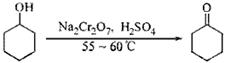
环己醇和环己酮的部分物理性质见下表
| 物质 |
相对分子质量 |
沸点(℃) |
密度(g/cm-3,20℃) |
溶解性 |
| 环己醇 |
100 |
161.1 |
0.9624 |
能溶于水和醚 |
| 环己酮 |
98 |
155.6 |
0.9478 |
微溶于水,能溶于醚 |
现以20mL环己醇与足量的Na2Cr2O7和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯,分离提纯过程中涉及到的主要步骤有(未排序)
a、蒸馏,除去乙醚后,收集151℃~156℃馏分
b、水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c、过滤
d、往液体中加入NaCl固体至饱和,静置,分液
e、加入无水MgSO4固体,除去有机物中少量水
(1)上述分离提纯步骤的正确顺序是(填字母)
(2)以下关于萃取分液操作的叙述中,不正确的是
A、水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,如图用力振荡
B、振荡几次后需打开分液漏斗上口的玻璃塞放气
C、经几次振荡并放气后,手持分液漏斗静置待液体分层
D、分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗口上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体
(3)蒸馏提纯时,下列装置中温度计位置正确的是,可能会导致收集到的产品中混有低沸点杂质的装置是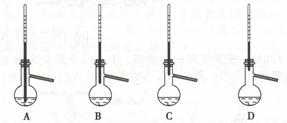
(12分)某学校研究性学习小组设计实验探究铝等金属的性质:将一置于空气中的铝片投入浓氯化铜溶液中,铝片表面出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,产生的气体,具有可燃性,溶液温度迅速上升。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是。
A.铝与Cl—反应,铝与SO42—不反应
B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化
D.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
E.生成氯化铝溶于水,而生成硫酸铝不溶于水
(2)放出的气体是,请分析开始阶段产生气体的速率不断加快的原因是。
(3)某同学通过其它的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.向硫酸铜溶液中加入氯化钠固体,再投入铝片
(4)除去氧化铝的铝片与镁片为电极,在X电解质溶液中构成原电池,列表如下:
| 选项 |
铝电极 |
电解质 |
负极反应 |
正极反应 |
| A |
负极 |
NaOH |
2Al-6e—+8OH—=2AlO2—+4H2O |
6H2O+6e—=6OH—+3H2↑ |
| B |
负极 |
稀盐酸 |
2Al-6e—=2Al3+ |
6H++6e—=3H2↑ |
| C |
正极 |
浓硝酸 |
Mg+2e—=Mg2+ |
2NO3—+4H+-4e—=2NO2↑+2H2O |
其中正确的是(填序号),由此推知,金属作电极不仅与本身性质相关,而且与有关。
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
(1)装置A是氯气的发生装置,其中盛放浓盐酸的仪器名称是____________,请写出该反应相应的化学方程式:。
(2)装置B中饱和食盐水的作用是;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应
是(填字母编号)。
| 编号 |
Ⅰ |
Ⅱ |
Ⅲ |
| a |
干燥的有色布条 |
碱石灰 |
湿润的有色布条 |
| b |
干燥的有色布条 |
无水硫酸铜 |
湿润的有色布条 |
| c |
湿润的有色布条 |
浓硫酸 |
干燥的有色布条 |
| d |
湿润的有色布条 |
无水氯化钙 |
干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是,该现象(填“能”或“不能”)说明溴单质的氧化性强于碘,原因是。
(5)装置F的作用是,其烧杯中的溶液不能选用下列中的(填字母编号)。
a.饱和NaOH溶液b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液d.饱和Na2CO3溶液
亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:①NO+NO2+2OH-=2NO2-+H2O;②气体液化的温度:NO2 21℃、NO–152℃。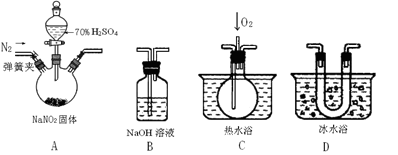
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接): A、、、。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是。②装置D的作用是。
(4)如果向C中通入过量O2,则装置B中发生反应的总化学方程式为。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是。