研究物质的合成或制备是有机化学、无机化学的重要任务之一。
(1)某实验小组探究实验室制备无水氯化镁的方法,设计了以下装置
①分液漏斗中的A物质是________________(填试剂名称)。
②利用中学常见的仪器,在答题卡中补充完整实验装置(不必画出夹持装置)。可选择的试剂有:稀NaOH溶液、无水氯化钙、稀硫酸、浓硫酸。
③假设实验过程中MgCl2▪6H2O未水解,不用任何试剂用最简单的方法检验MgCl2▪6H2O是否完全转化为MgCl2。写出实验方法________________
④工业生产中得到无水氯化镁可用于电解制备镁单质,电解装置中,镁在____极析出。
(2)实验室制备并收集纯净乙烯
①有的同学通过乙醇发生消去反应进行实验。除乙醇外,所需的试剂或用品(不包括仪器)有_________________。
②有的同学探究其它制备乙烯的方法,他设计了以下装置制备乙烯。实验结果是量筒内壁附着较多无色油状液体,且得到很少量的气体,请分析气体产率很低的原因主要是________________________。为增大气体产率,在右图装置的基础上,提出一点改进措施:__________________。
从实验安全角度考虑,该实验很可能发生的问题是____________________________。
海洋植物中含有丰富的碘元素,实验室从海藻中提取碘的流程如下图所示:
(1)写出提取碘的过程中有关的实验操作名称:①;③。写出操作③使用的所有玻璃仪器名称,并从下列选项中选出合理的提取用试剂。
A.酒精B.四氯化碳C.醋酸D.汽油
(2)写出操作②中有关反应的离子方程式:,有同学从绿色化学的角度出发提出用H2O2代替Cl2,试说明他的理由。(提示:H2O2+2I-+2H+ = I2+2H2O)
(3)操作③分离出来的废液中含有Cl-、SO42-,现只取一次试液,为了鉴别出Cl-、SO42-,从下列选项中选出依次加入的试剂:足量的、。
A.盐酸酸化的氯化钡 B.硝酸酸化的硝酸银
C.硝酸酸化的硝酸钡 D.硝酸酸化的氯化钡
(4)后期处理采用的是蒸馏操作,装置如图所示,
涉及物质的一些物理性质如下表:
| 物质 |
密度/g·cm-3 |
熔点/℃ |
沸点/℃ |
| 晶态碘(I2) |
4.933 |
113.7 |
184.3 |
| 某有机溶剂 |
1.584 |
-22.92 |
76.72 |
根据上述信息判断,下列说法正确的有。
A.装置图中温度计水银球的位置错误
B.装置图中冷凝水的流向错误
C.仪器A的名称是圆底烧瓶,仪器B的名称是冷凝管
D.蒸馏结束,晶态碘聚集在锥形瓶中
下图为某加碘盐标签的一部分。
已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学想定量测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液。
步骤2:取一支50mL碱式滴定管,用bmol·L-1的新制Na2S2O3 溶液润洗2~3次后,装满溶液,调节液面高度至0刻度。
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下: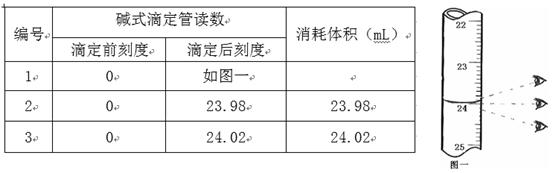
(1)第一次读数为mL。
(2)滴定终点的判断方法。
(3)经过计算,此碘盐碘元素的含量为mg·kg-1(用含a、b的最简表达式表示) 。
(4)下列操作可能会导致测量结果偏低的是。
| A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g |
| B.步骤1所配食盐溶液未完全转移至锥形瓶 |
| C.步骤2中滴定管洗涤后未润洗 |
| D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失 |
(5)请在答题纸的方框内画出正在排气泡的碱式滴定管(仅画出刻度以下部分)
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有。
(2)硫酸铜溶液可以加快氢气生成速率的原因是。
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 混合液 |
A |
B |
C |
D |
E |
F |
| 4mol·L-1H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中:V1=,V6=,V9=。
②反应一段时间后,实验E中的金属呈色。
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因。
(12分)中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g·L-1。某兴趣小组用下图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
(可能用到的相对原子质量:H—1 O—16 S—32) (1)仪器B的名称是,水通入A的进口为。
(1)仪器B的名称是,水通入A的进口为。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,写出该反应的离子方程式:。
(3)除去C中过量的H2O2,然后用0.0900mol·L-1NaOH标准溶液进行滴定,若滴定终点时溶液的pH=8.8,则选择的指示剂为;若滴定的实验操作如下:
①检查滴定管是否漏水
②用标准液润洗盛标准液的滴定管
③装标准溶液并调整液面(记录初读数)
④用蒸馏水洗涤玻璃仪器
⑤把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇至滴定终点,记下滴定管液面刻度。
则滴定操作的正确顺序是(用序号填写)____________________________;
(4)用标准NaOH溶液滴定时,以下操作引起误差偏大的是。
| A.滴定前仰视,滴定后俯视 |
| B.盛标准液的滴定管用蒸馏水洗后未用标准液润洗 |
| C.颜色改变立即读数 |
| D.盛标准液的滴定管滴前尖嘴部分有气泡,终了无气泡 |
(5)滴定至终点时,消耗NaOH溶液20.00mL,该葡萄酒中SO2含量为g·L-1
(10分)(1)下图所示是中学化学常用的玻璃仪器,请在下列操作中填入相应的仪器
①从氯化钠溶液中获得氯化钠晶体______。
②分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物______。
(2)实验室需用230ml 1.0mol/L的NaOH溶液
①在配制溶液过程中,上述仪器中还缺少的玻璃仪器是:________________玻璃捧等。
②计算需称量的NaOH固体质量为________________g
③配制过程中,下列操作情况会使结果偏低的是
| A.溶解后未冷却直接转移至容量瓶,立即定容 |
| B.转移溶液后,未洗涤烧杯和玻璃棒就直接定容 |
| C.定容时,俯视容量瓶刻度线观察液面 |
| D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,继续加水定容 |
(3)若1.0mol/LNaOH溶液的密度为1.1g/cm3,则质量分数为__________%