下图为某加碘盐标签的一部分。
已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O ②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学想定量测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液。
步骤2:取一支50mL碱式滴定管,用bmol·L-1的新制Na2S2O3 溶液润洗2~3次后,装满溶液,调节液面高度至0刻度。
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下: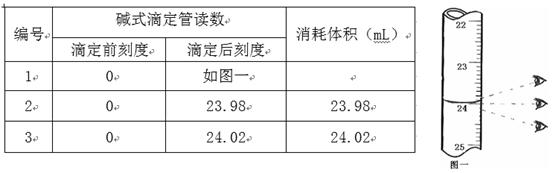
(1)第一次读数为 mL。
(2)滴定终点的判断方法 。
(3)经过计算,此碘盐碘元素的含量为 mg·kg-1(用含a、b的最简表达式表示) 。
(4)下列操作可能会导致测量结果偏低的是 。
| A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g |
| B.步骤1所配食盐溶液未完全转移至锥形瓶 |
| C.步骤2中滴定管洗涤后未润洗 |
| D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失 |
(5)请在答题纸的方框内画出正在排气泡的碱式滴定管(仅画出刻度以下部分)
(12分) 已知NH3是一种重要的还原试剂,在化学研究中应用十分广泛。某校化学探究性学习小组的同学,按有关实验原理和装置,进行氨的制备及性质的探究实验。请你分别参与甲、乙、丙、丁、戊组的实验探究,并根据题目的叙述及要求,回答下列问题: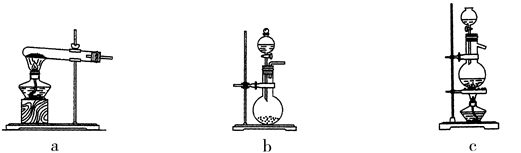
(1)甲、乙两组同学选择了不同的实验装置和试剂来制取氨气。
① 甲组实验装置是a,实验试剂是。
② 乙组实验试剂是浓氨水和氢氧化钠固体,实验装置是 (填编号)。
用化学平衡原理分析氢氧化钠固体的作用
(2)丙、丁两组同学选择了不同的方法来探究氨的催化氧化实验。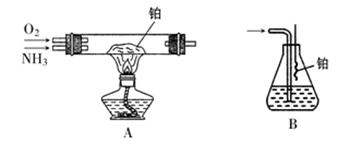
①丙组用A装置,加热铂丝一段时间后,通入NH3和O2,写出装置A硬质玻璃管中发生氨的催化氧化反应方程式,并且要求用双线桥标明电子转移的方向与数目:
② 丁组用B装置吸收一段时间氨气后,再通入空气,同时将红热的铂丝插入B装置的锥形瓶内,反应结束后,锥形瓶内溶液中含有的离子包括H+、OH-、。
(3)戊组的同学按照下列流程,探究不同催化剂对NH3还原NO反应的催化性能及速率:
【设计实验方案及操作】若控制其他条件均相同,在催化反应器中分别装载不同的催化剂,将经过催化反应后的混合气体,分别通入滴有酚酞的稀硫酸(溶液的体积、浓度均相同)中,比较不同催化剂的催化作用,应该测定 。
ClO2在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用图1所示装置模拟工业制取并收集ClO2。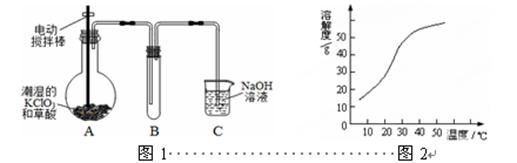
(1)A装置电动搅拌棒的作用是。A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、。
(2)B装置必须放在冰水浴中,其原因是。
(3)反应后在装置C中可得NaClO2溶液。已知(1)NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl;(2)NaClO2的溶解度曲线如图2所示,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;②;③;④低于60℃干燥;得到成品。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用cmol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL(已知2 Na2S2O3+ I2=Na2S4O6+ 2NaI)。
①配制100 mL c mol·L-1 Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有:。
②滴定过程中进行三次平行测定的原因是。
③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果。(填“偏高”、“偏低”或“不变” )
用18.4mol·L-1的浓硫酸,配制 100 ml 1.0 mol·L-1的稀硫酸,请回答以下问题:
(1)需要18.4mol·L-1的浓硫酸ml。
(2)下列哪组仪器在配制时不需要用到 ()
①托盘天平②分液漏斗③250ml容量瓶④烧杯⑤胶头滴管
⑥量筒⑦玻璃棒⑧铁架台(带铁夹)⑨100ml容量瓶
A.③④⑤⑦⑨ B.①②⑤⑥⑧ C.①②③⑧ D.③④⑤⑥
(3)下列实验步骤中,正确的操作顺序应该是:
A 用量筒量取浓硫酸,缓缓倒入装有约50ml蒸馏水的烧杯里,并用玻璃棒搅拌。
B 用约30ml蒸馏水,分出三次洗涤烧杯和玻璃棒,将每次洗涤液都倒入容量瓶中;
C 将稀释后的硫酸小心地倒入容量瓶中;
D.检查100ml容量瓶瓶口是否有漏液现象;
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1——2cm处;
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,至液面最低点与刻度线相切;
(4)进行A步骤操作的时候,应该选用
①10 ml量筒②50 ml量筒③5000 ml量筒④1000 ml量筒
(5)进行A步操作后,必须后,才能进行C步操作。
(14分)紫菜与海带类似,是一种富含生物碘的海洋植物。商品紫菜轻薄松脆、比海带更易被焙烧成灰实验室里从紫菜中提取碘的流程如下图: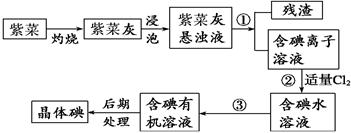
(1)实验室焙烧紫菜,需要下列仪器中的________(填序号)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①________,③__________。
(3)提取碘的过程中,可选择的有机试剂是 ( )
| A.酒精 | B.苯 | C.乙酸 | D.食盐水 |
选择该试剂的理由是。
(4)为使紫菜灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有______________、________________。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,观察下面实验装置图改正其中的错误之处: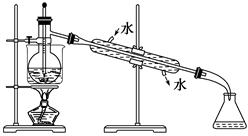
①_________________________________________;
②_________________________________________;
③_________________________________________。
(6)进行上述蒸馏操作时,使用水浴加热,最后晶态碘在里聚集。
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用来消
毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,欲准确测定过氧化
氢的含量。请填写下列空白:
(1)取10.00 mL密度为ρg/mL的过氧化氢溶液稀释至250mL。移取稀释后的过氧化
氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为。
(3)滴定时,将高锰酸钾标准溶液注入(填“酸式”或“碱式”)滴定管
中,滴定到达终点的现象是。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中
过氧化氢的质量分数为。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果(填“偏高”或“偏低”或“不变”)。