运用相关原理,回答下列各小题:
已知: 在水中的电离方程式为
在水中的电离方程式为
(1)常温下,PH=5的 溶液中水的电离程度 PH=9的
溶液中水的电离程度 PH=9的 中水的电离程度。(填“>”、”=”或“<”)
中水的电离程度。(填“>”、”=”或“<”)
(2)等体积等物质的量浓度的 与氨水混合后,溶液呈酸性的原因为 。(用离子方程式表示);若一定量的
与氨水混合后,溶液呈酸性的原因为 。(用离子方程式表示);若一定量的 溶液与氨水混合后,溶液PH=7,则
溶液与氨水混合后,溶液PH=7,则
 (填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中
(填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中 完全沉淀,则反应后溶液的PH= 7(填“>”、”=”或“<”)
完全沉淀,则反应后溶液的PH= 7(填“>”、”=”或“<”)
(3)将分别含有 的四种溶液混合,调节溶液的PH值,使PH=1,充分反应后:
的四种溶液混合,调节溶液的PH值,使PH=1,充分反应后:
①若 离子有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的是
离子有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的是
②若所得混合液呈紫色,上述四种离子在溶液中一定存在的有 ,
一定不存在的离子有 。
下图是一个电化学过程的示意图。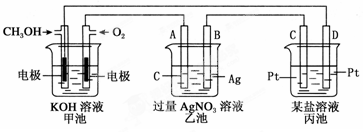
请回答下列问题:
(1)图中乙池是_______(填“原电池”“电解池”或“电镀池”)。
(2)A(石墨)电极的名称是________(填“正极”“负极”“阴极”或“阳极”)。
(3)写出通入CH3OH的电极的电极反应式:_____________________。
(4)乙池中反应的化学方程式为______________,当乙池中B(Ag)极质量增加5.4 g,甲池中理论上消耗O2的体积为________L(标准状况),此时丙池中电极(填“C”或“D”)析出1.6 g某金属,则丙池中的某盐溶液可能是________。
| A.MgSO4 | B.CuSO4 | C.NaCl | D.AgNO3 |
醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。
(1)醋酸钠溶液中各离子浓度由大到小的顺序为______________。
(2)对于醋酸溶液和醋酸钠溶液的下列说法正确的是______________(填字母,下同)。
| A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小 |
| B.升高温度可以促进醋酸电离,而升高温度会抑制醋酸钠水解 |
| C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离 |
| D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离 |
(3)物质的量浓度均为 0.1 mol/L 的 CH3COONa 溶液和 CH3COOH 溶液等体积混合(混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是______________
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要作用。
(1)真空碳热还原一氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+ 2AlCl3(g)+ 6C(s)=6AlCl(g)+ 6CO(g);△H= a kJ•mol-1
3AlCl(g)= 2Al(l)+ AlCl3(g);△H= b kJ•mol-1
反应Al2O3(s)+ 3C(s)= 2Al(l)+ 3CO(g)的△H=_______kJ•mol-1
(用含a、b的代数式表示)。
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g) N2(g)+ CO2(g);△H= Q kJ•mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+ CO2(g);△H= Q kJ•mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol/L) |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.68 |
0.50 |
0.50 |
0.60 |
0.60 |
| N2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
| CO2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
①0~10min内,NO的平均反应速率v(NO)=_______,T1℃时,该反应的平衡常数K=_______
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是_______(填字母编号)
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q_______0(填“>”或“<”)。
④在恒容绝热条件下,能判断该反应一定达到化学平衡状态的依据是______________(填选项编号)
a.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列 △ H 表示物质燃烧热的是_______(填字母编号)。

(2)依据上述热化学方程式,稀硝酸与氢氧化钾溶液发生中和反应的热化学方程式为______________(其中热效应从上述 △H1~△H7尽中选取)。
(3)中和热的测定是高中化学的定量实验之一。50 mL0.50 mol/L 盐酸与 50 mL 0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。从实验装置上看,图中尚缺少的一种仪器是_______。大烧杯上如不盖硬纸板,求得的中和热数值将会_______(填“偏大”、“偏小”或“无影响”)。
二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用水煤气合成二甲醚,总反应为:
3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) ΔH=-246.4 kJ/mol
CH3OCH3(g)+CO2(g) ΔH=-246.4 kJ/mol
(1)在一定条件下的密闭容器中,该总反应达到平衡,只改变一个条件能同时提高反应速率和CO的转化率的是________(填字母代号)。
a.降低温度 b.加入催化剂 c.缩小容器体积 d.增加H2的浓度 e.增加CO的浓度
(2)该反应的化学平衡常数表达式K=_______。
温度升高平衡常数_______(填“变大”、“变小”、“不变”)
(3)在一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,在一定温度和压强下发生反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。
CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。
问:①反应开始时正、逆反应速率的大小:v(正)________v(逆)(填“>”“<”或“=”),理由是。
②平衡时n(CH3OCH3)=________,平衡时CO的转化率为________。
③在该反应条件下能判断反应达到化学平衡状态的依据是________(填编号)。
A v(CO)=3v(CO2)B生成a mol CO2的同时消耗3a mol H2
C c(CO2)=c(CO)D混合气体的平均相对分子质量不变
E气体的密度不再改变F气体的总质量不再改变