关注饮用水,保证人民的生活质量。回答下列两个问题:
(1)饮用水中的NO3— 对人类健康会产生危害,为了降低饮用水中NO3—的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:
10Al + 6NaNO3 + 4NaOH = 10NaAlO2 + 3N2↑+ 2H2O。请回答下列问题:
①上述反应中, 元素的化合价升高,则该元素的原子 (填“得到”或“失去”)电子。
②用“单线桥法”表示反应中电子转移的方向和数目:
10 Al+ 6 NaNO3 + 4 NaOH =" 10" NaAlO2 + 3 N2↑+ 2 H2O
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为
。
②漂白粉的有效成分是(填化学式) 。
③漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,离子方程式为 。
实验室用密度为1.84g·cm-3,溶质的质量分数为98%的硫酸,配制250mL物质的量浓度为0.46mol·L-1的硫酸。
(1)98%的浓硫酸的物质的量浓度为 。
(2)现有下列几种规格的仪器,应选用 (用序号填空)。
①10mL量筒 ②50 mL量筒 ③100mL量筒 ④100mL容量瓶 ⑤250mL容量瓶
(3)容量瓶上标有 、 和 。
(4)下列操作使所配溶液的物质的量浓度偏高的是 。
| A.往容量瓶中转移溶液时有少量液体溅出 | B.未洗涤稀释浓H2SO4的小烧杯 |
| C.定容时俯视刻度线 | D.洗净容量瓶未干燥即用来配制溶液 |
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
(1)8g CH4共有 mol氢原子,0.1molNH3共有约 个原子,同温同压下,同体积的NH3和H2S气体的质量比为 ;同温同压下,同质量的NH3和H2S气体的体积比为__ __。
(2)在标准状况下,15g某气体的分子数与11.2L CO的分子数相等,则该气体的摩尔质量为 。
(3)V L Fe2(SO4)3溶液中含Fe3+m g,则该溶液中Fe3+的物质的量浓度为_____ mol·L-1,溶质的物质的量浓度为______ mol·L-1。
(4)用脱脂棉包住约0.2g过氧化钠粉未,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉燃烧起来。由实验现象所得出的有关过氧化钠和水反应的结论是:a:有氧气生成;b Na2O2和水反应的化学方程式是 。
(12分)以下12种物质为中学化学中常见的物质:
①Cu②KCl③NaHSO4④SO3⑤H2SO4⑥C2H5OH(酒精)
⑦CaCO3 ⑧BaSO4 ⑨Cu(OH)2 ⑩Fe(OH)311NaOH 12 CaO
请按下列要求回答(填写物质的标号):
(1)属于电解质的是 。
(2)在水溶液中能电离出H+的是 ,属于酸的是 。
(3)属于碱的是 ,其中难溶性碱为 。
(4)难溶性盐是 。
为除去粗盐中的Ca2+、Mg2+、SO以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):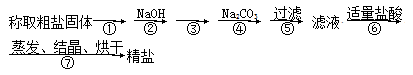
(1)步骤①的操作名称是 ,需要用到的仪器有______________、__________________。
(2)第③步中,加入的试剂是__________________(填化学式),判断该试剂已过量的方法是 。
(3)第④步中涉及反应的离子方程式 、 。
(4) 若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是 。
(1)下面是几种实验中常用的仪器: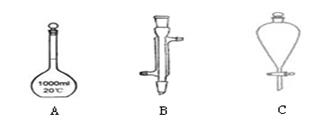
写出序号所代表的仪器的名称:A ;B ;C 。
实验室要配制500mL 0.2mol/L Na2CO3溶液,请回答下列问题:
(2)若用Na2CO3·10H2O配制该溶液,需用托盘天平称取其质量为 g。
(3)配制过程中,造成浓度偏低的操作可能有 。
| A.容量瓶用蒸馏水洗后未加干燥。 |
| B.将烧杯中的Na2CO3溶液移入容量瓶后,未用水洗涤烧杯。 |
| C.加水时不慎超过刻度线,用胶头滴管吸出部分溶液,使凹液面与刻度线相切。 |
| D.定容时,俯视液面加水至刻度线。 |
(4)右图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线。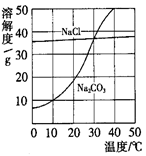
①当温度 时,氯化钠的溶解度大于碳酸钠的溶解度;
②生活在盐湖附近的人们习惯 “夏天晒盐,冬天捞碱”。
请你解释原因“夏天晒盐” ;
“冬天捞碱” 。