下图为阳离子交换膜法以石墨为电极电解饱和硫酸钠溶液的原理示意图。已知Na2SO4溶液从A口进料,含少量NaOH的水从B口进料,据图分析,下列说法不正确的是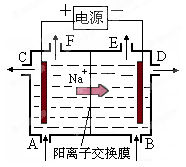
| A.阳极的电极反应式为4OH--4e-= 2H2O+O2↑ |
| B.从E出口逸出的气体是H2 |
| C.从D出口流出的是较浓的NaOH溶液 |
| D.电路中转移4 mol电子时,阳极区有1 mol H2SO4生成 |
.以氨气代替氢气来研发氨燃料电池是当前科研的一个热点。氨燃料电池使用的电解质溶液是KOH溶液,电池反应为: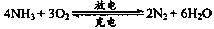
有关下列说法错误的是()
| A.氨燃料电池在放电时,氨气被氧化 |
| B.氨燃料电池在放电时,正极反应为:2NH3+6e-+6OH- |
| C.以氨气代替氢气的主要原因是:氨气易液化易储存 |
| D.燃料电池的能量转化率一般比普通的电池高 |
下列表示可逆反应:2A(g)+B(g) 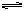 D(g) △H<0的图示中正确的是( )
D(g) △H<0的图示中正确的是( )
(atm压强的一种单位)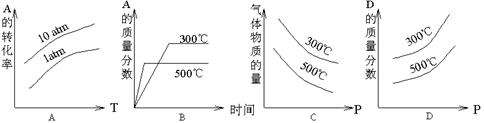
某种电池的总反应为 Fe+NiO2 + 2H2O  Fe(OH)2+Ni(OH)2。下列有关该蓄电池的说法错误的是( )
Fe(OH)2+Ni(OH)2。下列有关该蓄电池的说法错误的是( )
| A.放电时Fe是负极,NiO2是正极 |
| B.放电时正极反应是:NiO2+H2O+2e-=。Ni(OH)2+2OH- |
| C.放电时负极反应为: Fe-2e-+2OH-=Fe(OH)2 |
| D.该蓄电池的电极应该浸入某种碱性电解质溶液中 |
某温度下的密闭容器中,发生如下可逆反应:2E(g)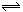 F(g)+xG(g)△H<0,若起始时E的浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5 a mol/L;若E的起始浓度改为2 a mol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是( )
F(g)+xG(g)△H<0,若起始时E的浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5 a mol/L;若E的起始浓度改为2 a mol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是( )
| A.升高温度时,正反应速率加快,逆反应速率减慢 |
| B.若x=1,容器体积保持不变,新平衡下E的体积分数为50% |
| C.若x="2,容器体积保持不变,新平衡下F的平衡浓度为0.5a" mol/L |
| D.若x="2,容器压强保持不变,新平衡下E的浓度为a" mol/L |
化学用语是表示物质组成、结构和变化规律的一种具有国际性、科学性和规范性的书面语言。下列化学用语中,书写错误的是()
A.硫离子的结构示意图: |
B.NH4Cl的电子式: |
| C.CO2的电子式: ············ | D.次氯酸的结构式: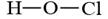 |