(每空格3分,计15分)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度 (×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡的是_______ ____。
A. B.密闭容器中总压强不变
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数:__________________________。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量____ __(填“增加”、“减小”或“不变”)。
④氨基甲酸铵分解反应的焓变△H__ __0,熵变△S__ _0(填>、<或=)。
写出金属钠与硫酸铜溶液反应的离子方程式:_________.
如果某粗盐的溶液中含有少量的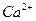 、
、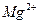 、
、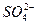 ,用①盐酸调PH值、②氯化钡溶液、③碳酸钠溶液、④氢氧化钠溶液,结合⑤过滤操作除去杂质时,正确的顺序是____________________________(填编号)
,用①盐酸调PH值、②氯化钡溶液、③碳酸钠溶液、④氢氧化钠溶液,结合⑤过滤操作除去杂质时,正确的顺序是____________________________(填编号)
有机物E和F可用作塑料的增塑剂或涂料的溶剂。它们的相对分子质量相等,可以用下图所示方法合成。(已知

(1)试写出有机物的名称:A____________;B____________。
(2)写出下列转化的化学方程式
A+D→E:____________ B+G→F:____________
(3)×的反应类型及其条件:类型____________;条件____________。
在课外实验中,某学生用蔗糖、碳铵、生石灰、硫酸四种药品,从AgNO3(内含少量Fe3+和Al3+),废液中提取单质银,其流程图如下图所示:
(1)写出沉淀D的成分____________,A的成分____________
(2)写出反应②的化学方程式:________________________________
(3)写出生成C的离子方程式:________________________________
(4)写出③的离子方程式________________________________
32. 稀土是我国丰产元素,几种稀土元素可用有机萃取剂分离。A是一种有机萃取剂,结构简式:
(1)A所属化合物类型是____________。
(2)A可由有机物B与无机物C通过____________反应制得,写出B的简式____________,C的分子式____________。
(3)若1分子B在一定条件下可脱去2分子水生成D,D的结构简式____________。