(每空格3分,计18分)工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH—(aq)
Cr3+(aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的阳极反应式为:
。
(5)在阴极附近溶液pH升高的原因是(用电极反应解释) 。溶液中同时生成的沉淀还有 。
(17分)A、 B、C、D为四种元素,A原子的1S轨道为半充满;在元素周期表中,B的电负性最大;C2+的电子排布式和Ar相同;D的原子序数为24。
(1)判断元素:A、B、C、D。
(2)以上这四种元素中,属于d区的是______________________(填元素符号)。
(3)C在周期表中的位置为________周期________族。
(4)写出CB2的电子式。
(5)元素D的化合物(DO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素还有__________(填元素符号
②DO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断DO2Cl2是__________(填“极性”或“非极性”)分子。
(17分)某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色;J分子内有两个互为对位的取代基。在一定条件下有如下的转化关系(无机物略去):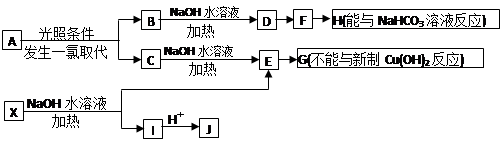
(1)属于芳香烃类的A的同分异构体中,其沸点的大小关系为
(不包括A,用结构简式表示)
(2)J中所含的含氧官能团的名称为 、 ;
(3)E与H反应的化学方程式是
其反应类型是
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物K,以K为单体合成的高分子化合物的名称是
(5)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式
①与FeCl3溶液作用显紫色;②与新制Cu(OH)2悬浊液作用产生红色沉淀;③苯环上的一卤代物有2种。
化合物A最早发现在酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得,A的钙盐是人们喜爱的补钙剂之一。A在铜或银的存在下用空气进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下图所示的反应。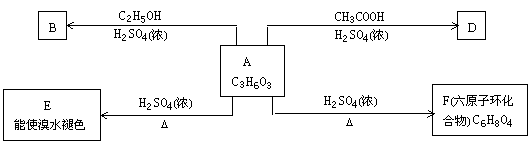
试写出:(每空3分)
(1)化合物的结构简式:A
(2)化学方程式:
A ® E
A ® F
下图是从苯酚的乙醇溶液中分离回收苯酚的操作流程图: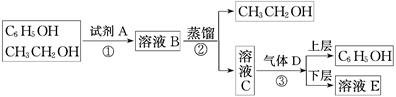
根据图示完成下列问题:
(1)试剂A的化学式为______________ (2)步骤③的操作名称为________________
(3)写出C+D―→E+C6H5OH的化学方程式:___________________________________
(6分)(1)相对分子质量为70的烯烃的分子式为________;若该烯烃与足量的H2加成后能生成含3个甲基的烷烃,则该烯烃的可能为________ 种。
(2)某化合物仅含碳、氢、氧三种元素,相对分子质量为110。与FeCl3溶液作用显现特征颜色,且核磁共振氢谱图像仅有2个波峰,强度比为2∶1。则它的结构简式为。