下列各组物质① O2和O3 ② H2、D2、T2③12C和14C ④ CH3CH2CH2CH3和(CH3)2CHCH3⑤乙烷和丁烷⑥ CH3CH2CH2CH(C2H5)CH3和 CH3CH2CH2CH(CH3)C2H5
根据题意填空(只填序号),
(1)同系物的是_ ;(2)同分异构体的是___。(3)同位素的是__;(4)同素异形体的是___。
工业上合成甲醇一般采用下列反应: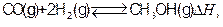 下表是该反应在不同温度下的化学平衡常数(K):
下表是该反应在不同温度下的化学平衡常数(K):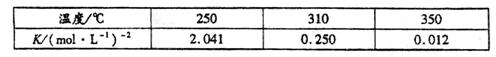
(1)由表中数据判断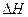 0(填“>”、“=”或“<”)。
0(填“>”、“=”或“<”)。
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.5mol·L-1,则此时的温度为℃。
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表: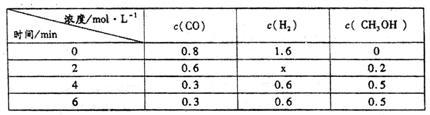
①反应从2min到4min之间,H2的反应速率为。
②反应达到平衡时CO的转化率为。
③反应在第2min时改变了反应条件,改变的条件可能是(填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度
(4)常温常压 下:
下:
①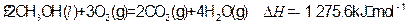
②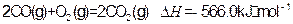
③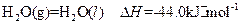
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(5)一种甲醇燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧化作用生成水和二氧化碳。该电池的负极反应式为:。
若以上述燃料电池为电源来电解饱和食盐水,当消耗32g甲醇时,电解产生的H2体积(标况)为L。
(14分)Ⅰ.反应物与生成物有:浓H2SO4、K2S、K2SO4、SO2、H2O和一种未知物质X。
(1)已知K2S在反应中失去电子,则该反应的氧化剂是。
(2)已知0.5molK2S在反应中失去1mol电子生成X,则X的化学式为。
(3)将氧化剂和还原剂及其配平后系数填入下列空格中,并标出电子转移的方向和数目: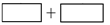
(4)若反应中浓H2SO4过量,则 产物中无X生成,请完成此化学反应方程式:。
产物中无X生成,请完成此化学反应方程式:。
Ⅱ .短周期元素X、Y、Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1﹕1的离子化合物A,X与Z能形成原子个数比为1﹕1的共价化合物B,它们之间能实现如图所示转化(部分产物已略去):
.短周期元素X、Y、Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1﹕1的离子化合物A,X与Z能形成原子个数比为1﹕1的共价化合物B,它们之间能实现如图所示转化(部分产物已略去):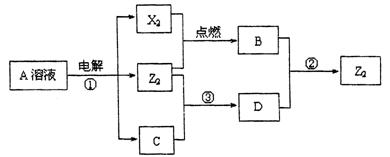
(1)Y在周期表的位置是;
(2)反应①的化学方程式是
 。
。
(3)D溶液呈碱性的原因是(用离子方 程式表示)。
程式表示)。
D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应。某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z2,仪器装置如图所示(夹持固定装置的仪器已略去)。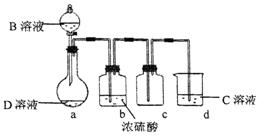
(4)写出反应②的离子方程式。
(5)上述实验装置不够完善,改进方法是。
除去括号中杂质,写出所加试剂与反应的离子方程式。
(1)SO42― (CO32― ),所加试剂:,离子方程式
(2)Cl―― (SO42― ),所加试剂:,离子方程式
(3)Fe2+ (Cu2+),所加试剂:,离子方程式
(4)BaCl2 (HCl ),所加试剂:,离子方程式
某无色透明溶液中可能大量存在Ag+,Mg2+,Cu2+中的几种离子。
(1)不做任何实验就可以肯定原溶液中不存在的离子是_________。
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定有的离子是___________,有关的离子反应式为_____________。
(3)取(2)的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子有_______________。
(4)原溶液中可能大量存在的阴离子是下列A-D中的(填序号)_________。
| A.Cl- | B.NO3- | C.CO32- | D.OH- |
已知:(1)A是XY型氧化物,它是黑色粉末;(2)将A和稀硫酸共热,得溶液B,向B中滴入适量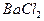 溶液,生成白色沉淀,过滤后得滤液C;(3)将C分成两份,在一份中加入烧碱溶液,可得蓝色絮状沉淀D;(4)往另一份C中放入一枚新铁钉,有单质E析出。已知A、B、C、D、E相互关系如图所示。
溶液,生成白色沉淀,过滤后得滤液C;(3)将C分成两份,在一份中加入烧碱溶液,可得蓝色絮状沉淀D;(4)往另一份C中放入一枚新铁钉,有单质E析出。已知A、B、C、D、E相互关系如图所示。
(1)写出A、B、C、D、E各物质的化学式:A__________,B__________,C__________,D__________,E__________。
(2)请写出上述反应中离子方程式。
;
;