(1)2 molO3与3 molO2的质量之比_______,分子数之比_______,同温同压下的密度之比_____,含氧原子数之比_______,体积之比_______.
(2)O3与Cl2具有相似的性质,均可用于自来水的消毒.已知二者在消毒时均被还原为最低价态,则相同状况下10 L O3与________L Cl2的消毒能力相当.
(3)气体化合物A分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为________,推断的依据为_______________________
取一支洁净试管,向试管中加入0.1mol·L-1AgNO3溶液2 mL,再向硝酸银溶液
中加入足量的铜粉,反应足够长时间后,取上层清液于另一支试管中,再向该试管中滴加
0.1 mol·L-1KI溶液。回答有关上述实验的下列问题:
(1)可判断硝酸银溶液和铜的反应(正向反应)已确实发生的现象是。
(2)可判断硝酸银溶液和铜的反应的逆反应也同时发生的现象是。
(3)实验中若将KI溶液换成KCl溶液,则可能出现什么不同的现象?______
下列各物质:①O2、O3②H2、D2、T2③12C、14C
④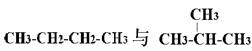 ⑤
⑤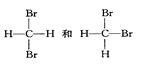
互为同分异构体的是(填序号,下同);互为同位素的是
互为同素异形体的是;是同一种分子的是
在2
密闭容器内,800 ℃时反应:
 ,
体系中,
随时间的变化如表:
,
体系中,
随时间的变化如表:
| 时间(
) |
0 |
1 |
2 |
3 |
4 |
5 |
| 0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)用
表示从0~2
内该反应的平均速率
。 (2)右图中表示
浓度的变化的曲线是。
(2)右图中表示
浓度的变化的曲线是。
(3)能说明该反应已达到平衡状态的是。
A.
B.容器内压强保持不变
C.
逆
=2
正
D.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是。
A.及时分离除
气体B.适当升高温度
C.增大
的浓度D.选择高效催化剂
常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的pH。
(3)电解至t3时,消耗水的质量。
(1)已知常温时32g甲烷燃烧放出的热量为akg,写出甲烷标准燃烧热的热化学方程式;
(2)以甲烷为燃料和KOH溶液为电解质制成燃料电池。
其电池负极反应式是:;
其电池总反应化学方程式是:。