锰锌铁氧体可制备隐形飞机上吸收雷达波的涂料。以废旧锌锰电池为原料制备锰锌铁氧体(MnxZn1-xFe2O4)的主要流程如下,请回答下列问题:
(1)酸浸时,二氧化锰被双氧水还原的化学方程式为 。
(2)活性铁粉除汞时,铁粉的作用是 (填“氧化剂”或“还原剂”或“吸附剂”)。
(3)除汞是以氮气为载气吹入滤液中,带出汞蒸汽经KMnO4溶液进行吸收而实现的。下图是KMnO4溶液处于不同pH时对应Hg的单位时间去除率变化图,图中物质为Hg与 MnO4-在该pH范围内反应的主要产物。
①pH<6时反应的离子方程式为 。
②请根据该图给出pH对汞去除率影响的变化规律: 。
③试猜想在强酸性环境下汞的单位时间去除率高的原因: 。(不考虑KMnO4在酸性条件下氧化性增强的因素)
(4)当x=0.2时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物的形式表示该锰锌铁氧体的组成 。
(5)经测定滤液成分后,需加入一定量的MnSO4和铁粉,其目的是 。
在铜锌原电池中,以硫酸铜溶液为电解质溶液;
锌为极,电极上发生的是________反应(“氧化”或“还原”),电极反应式为____ ______,锌片表面可观察到的现象是:__________;铜为__ ___极,电极上发生的是__ ______反应(“氧化”或“还原”),电极反应式是___ _ ______,铜表面上可观察到的现象是:_ _________;
对于反应2SO2(g)+O2(g) 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
| 编号 |
改变的条件 |
生成SO3的速率 |
| ① |
降低温度 |
|
| ② |
加入氮气 |
|
| ③ |
用催化剂 |
|
| ④ |
压缩体积 |
有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物。
试根据以上叙述回答:
(1)元素名称: A ______ B _____ C _____ D ______。
(2)D元素位于周期表中周期族。
(3)写出AB2与C2B2反应的化学方程式。
(4)画出B的原子结构简图 ___________________。
(5)用电子式表示化合物 C2D 的形成过程:。
(12分)化学式为C11H12O4的芳香族化合物A、B互为同分异构体,A和D都能发生银镜反应,E的一溴取代物同分异构体有两种,A经①②两步反应得C、D和E。B经①②两步反应得E、F和H。上述反应过程、产物性质及相互关系如图所示。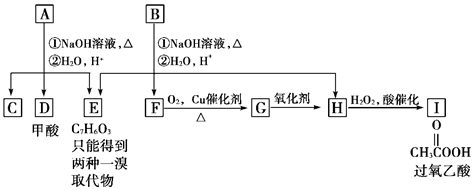
(1)A有2种可能结构,写出其结构简式:____________________________________。
(2)在B、C、D、F、G、I化合物中,互为同系物的是__________________________。
(3)写出D与F在加热和浓H2SO4催化作用下发生反应的化学方程式:
_________________________________。反应类型:__________________。
(4)除银镜反应和点燃外至少选用其他两种实验方法证明D具有还原性,请按要求填写下表:
| 所选试剂的化学式 |
观察到的实验现象 |
|
| 方法1 |
||
| 方法2 |
工业上用甲苯生产对羟基苯甲酸乙酯 ,其生产过程如下图,根据下图回答:
,其生产过程如下图,根据下图回答: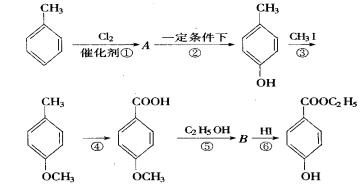
(1)有机物A的结构简式为。
(2)反应⑤的条件是
(3)反应②的反应类型是(填编号,下同),反应④的反应类型属。
| A.取代反应 | B.加成反应 | C.氧化反应 | D.酯化反应 |
(4)反应③的化学方程式(不用写反应条件,但要配平):
。
(5)在合成线路中,设计第③和⑥这两步反应的目的是:
。