根据下列实验设计及有关现象,所得结论不正确的是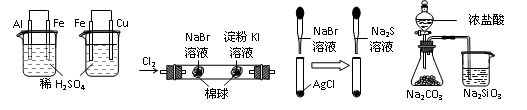
A B C D
| 实 验 |
实验现象 |
结 论 |
| A |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
| B |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
| C |
白色固体先变为淡黄色,后变为黑色(Ag2S) |
溶解性 :AgCl>AgBr>Ag2S |
| D |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
酸性:HCl>H2CO3>H2SiO3 |
下列物质的漂白原理相近的组合是①C12②HClO③Ca(ClO)2④SO2⑤O3
⑥Na2O2⑦H2O2⑧木炭
| A.①②③④⑥⑦ | B.①②③⑤⑥⑦ |
| C.①②⑤⑥⑦ | D.④⑤⑥⑦⑧ |
用NA表示阿伏加德罗常数,下列叙述中正确的是
| A.5.6g金属铁与足量稀盐酸反应完全反应时,失去0.3NA个电子 |
| B.20g重水(2H2O)含有10NA个电子 |
| C.0.1mol/L的氯化铝溶液500mL,氯离子的物质的量浓度为0.15 mol/L |
| D.在常温常压下,11.2 L氮气所含的原子数目为NA |
下列关于化学反应说法中正确的是
| A.化学键的断裂和形成是化学反应中能量变化的主要原因 |
| B.化学反应速率为0.8 mol /(L·s)是指1s 内生成0.8mol该物质 |
| C.可逆反应达到平衡时,各物质的质量不变, |
| D.化学反应的限度不可以通过改变条件而改变 |
下列说法中正确的是()
| A.镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池 |
| B.燃料电池是一种高效但是会污染环境的新型电池 |
| C.化学电池的反应基础是氧化还原反应 |
| D.铅蓄电池放电的时候正极是Pb负极是PbO2 |
化学变化中通常伴随着颜色变化,下列颜色变化不是因化学反应引起的是
| A.无色试剂瓶中的浓硝酸呈黄色 | B.久置的KI溶液呈黄色 |
| C.新制氯水久置后变为无色 | D.普通玻璃导管口点燃纯净氢气时,火焰呈黄色 |