11分).某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:

请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 ,(填仪器名称)操作II必须用到的仪器是 。(填下列编号)
| A.50mL烧杯 | B.20mL量筒 | C.50mL量筒 | D.25mL滴定管 |
(2)请写出加入溴水发生的离子反应方程式 ,
(3)检验沉淀是否已经洗涤干净的操作是
。
(4)若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 (列出原始算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是 (写出一种原因即可)
草酸亚铁晶体(FeC2O4·2H2O)呈淡黄色。某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究。
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到有二氧化碳气体生成。这说明草酸亚铁晶体具有 _ (填“氧化性”、“还原性”或“碱性”)。若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为______ mol。
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体。课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO;
假设二: ______ ;
假设三: ______。
(3)为验证上述假设一是否成立,课题组进行如下研究。
【定性研究】请你完成下表中内容。
| 实验步骤(不要求写出具体操作过程) |
预期实验现象和结论 |
| 取少量黑色固体,_________________ _________________________________ |
______________________________ ______________________________ |
【定量研究】课题组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如下图所示: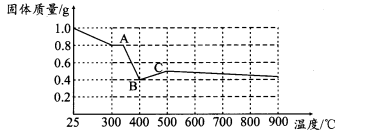
写出加热到400℃时,FeC2O4·2H2O晶体受热分解的化学方程式为:__________________。
过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在NH4Cl溶液中加入Ca(OH)2;
②在第①步的生成的产物中加入30% H2O2,反应生成CaO2•8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2•8H2O,再脱水干燥得到CaO2。
完成下列填空:
(1)第①步反应的化学方程式为 ________。
(2)生产中可循环使用的物质是 。
(3)检验CaO2•8H2O是否洗净的方法是 ________________ 。
(4)已知CaO2在350℃迅速分解生成CaO和O2。如图是实验室测定产品中CaO2含量的装置(夹持装置省略)。
若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为 (用字母表示)。过氧化钙的含量也可用重量法测定,需要测定的物理量有 ______ 。
海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)步骤①所需要的硅酸盐仪器是___________ ,步骤③的实验操作是___________。
(2)步骤⑤中,某学生选择用苯来提取碘水中的单质碘的理由是 _______ 。(选填序号)
a.单质碘与苯不发生化学反应 b.碘在苯中溶解度小
c.碘在苯中溶解度大 d.苯与水互不相溶
(3)提取碘的过程中,不能使用的有机溶剂是 ___ 。(选填序号)
a.酒精 b.汽油 c.四氯化碳
(4)步骤④中所发生的离子反应方程式 _____________。
(5)已知:2Fe3++2I-→2Fe2++I2氯气既可以氧化Fe2+,也可以氧化I-。 往FeI2溶液中通入一定量的 Cl2,反应完成后,溶液中有1/2Fe2+被氧化,请写出该反应的化学反应方程式:__________。
用固体烧碱配制0.4mol·L-1的NaOH溶液240mL:
(1)实验仪器:托盘天平(含砝码)、烧杯、玻璃棒、____________、____________。
(2)称量____________g的NaOH。
(3)称量烧碱的动作要迅速,原因是: _________ 。
(4)下列操作中,会使所配制溶液浓度偏高的是 。(选填字母序号)
| A.NaOH在烧杯中溶解后立即转移到容量瓶 |
| B.定容时俯视读数 |
| C.定容、摇匀、静置,发现液面低于刻线,再加水至刻度线 |
| D.容量瓶没有干燥即用来配制溶液 |
E.溶解烧碱的烧杯未洗涤
海水开发利用的部分过程如图所示。下列说法错误的是
| A.向苦卤中通入Cl2是为了提取溴 |
| B.粗盐可采用除杂、过滤、蒸发结晶等过程提纯 |
| C.工业生产常选用NaOH作为沉淀剂 |
| D.单质溴可用SO2将其还原吸收 |