下列热化学方程式正确的是(△H的绝对值均正确) ( )
| A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=—1367.0 kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热) |
| C.S(s)+O2(g)===SO2(g);△H=—269.8kJ/mol(反应热) |
| D.2NO2==O2+2NO;△H=+116.2kJ/mol(反应热) |
PH=3的盐酸和醋酸各100mL,分别和锌反应,反应完后,放出的气体一样多。若最后有一溶液中锌剩余,则下列判断正确的是 ( )
| A.反应开始时速率v(HCl)> v(CH3COOH) |
| B.加入的锌质量相等 |
| C.盐酸中锌有剩余 |
| D.反应开始后不久,醋酸反应的速率小于盐酸 |
在某恒定温度下,向容积为1 L的容器中投入1 mol CO和2 mol H2O,发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g),平衡时生成CO2 2/3 mol。若保持温度和容积不变,向其中增加2 mol H2O(g),使反应到达新的平衡,下列说法不正确的是()
| A.新、旧平衡时容器内气体的压强之比是5:3 |
| B.新平衡时H2O的转化率为20% |
| C.新平衡时CO的浓度是0.2 mol ·L-1 |
| D.新、旧平衡时容器内气体密度之比为5:3 |
在恒温恒容条件下,将4molA和2molB放入一密闭容器中2A(g)+B(g) 2C(g)+D(s),
2C(g)+D(s),
达到平衡时,C的体积分数为a;在相同条件下,按下列配比分别投放A、B、C、D,达
到平衡时,C的体积分数不等于a的是:()
A.4mol、2mol、0mol、2mol B.2mol、1mol、2mol、2mol
C.2mol、1mol、2mol、1mol D.2mol、1mol、0mol、1mol
对可逆反应4NH3(g) + 5O2(g) 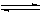 4NO(g) + 6H2O(g),下列叙述正确的是()
4NO(g) + 6H2O(g),下列叙述正确的是()
| A.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| B.达到化学平衡时,4v正(O2)= 5v逆(NO) |
| C.化学反应速率关系是:2v正(NH3)= 3v正(H2O) |
| D.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
密闭容器中的可逆反应3A(g)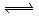 3 B+C ΔH="+890" kJ/mol(A的式量为120)随着温度升高,容器中气体相对平均分子质量减小,则下列判断正确的是( ).
3 B+C ΔH="+890" kJ/mol(A的式量为120)随着温度升高,容器中气体相对平均分子质量减小,则下列判断正确的是( ).
| A.若C为固体,则B一定是气体 |
| B.B和C一定都是气体 |
| C.若起始时往容器中投入18 g A,则反应吸收的热量为44.5 kJ |
| D.若起始时往容器中投入18 g A,则反应放出的热量为44.5 kJ |