短周期元素A、B、C原子序数依次增大,它们的原子的最外层电子数之和为10。A与C在周期表中处于同主族,B原子最外层电子数等于A原子次外层电子数。下列叙述正确的是( )
A.原子半径A<B<C B.A的氢化物的稳定性大于C的氢化物
C.B的氧化物的熔点比A的氧化物低 D.A与C可形成离子化合物
铜和镁的合金4.6 g完全溶于浓硝酸,若反应中硝酸被还原只产生5.152L的NO2气体(已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
| A.9.02 g | B.8.51 g | C.8.26 g | D.7.04 g |
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示。则下列有关说法中,不正确的是
| A.还原性:I— >Fe2+>Br— |
| B.原混合溶液中FeBr2的物质的量为6mol |
| C.当通入2molCl2时,溶液中已发生的离子反应可表示为: 2Fe2++2I-+2Cl2===2Fe3++I2+4Cl- |
| D.原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
在下列物质转化关系中,反应的条件和部分产物已略去。已知甲、乙是两种常见金属,甲的焰色反应呈黄色,乙与H2O需要在高温下反应,反应Ⅲ是工业制盐酸的反应,则下列说法正确的是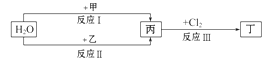
| A.工业上生产甲可以用热还原法 |
| B.反应Ⅱ的另外一种产物具有磁性 |
| C.向乙与Cl2反应产物的溶液中滴加KSCN溶液,无明显现象 |
| D.当有1mol乙参加反应Ⅱ时转移8mol电子 |
已知A、B为单质,C为化合物,它们之间存在如下转化关系则下列说法中正确的是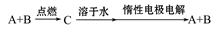
①若C溶于水后得到强碱溶液,则A可能是Na
②若向C溶液中逐滴加入NaOH溶液的过程中,溶液中出现白色沉淀并逐渐消失,则A可能Al ③若C的溶液遇NaHCO3固体,放出CO2气体,则A可能是H2
③若C的溶液遇NaHCO3固体,放出CO2气体,则A可能是H2
④若C的溶液中滴加KSCN溶液显红色,则B可能为Fe
⑤若C的溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①②③ B.②④ C.③⑤ D.①④⑤
下列实验不能达到预期目的的是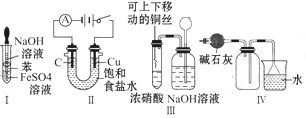
| A.利用Ⅰ制取Fe(OH)2 |
| B.利用Ⅱ装置电解饱和食盐水 |
| C.利用Ⅲ装置进行铜与浓硝酸反应的实验 |
| D.利用Ⅳ装置收集NH3 |