阅读下表中部分短周期主族元素的相关信息:
请回答:
| 元素代号 |
相关信息 |
| X |
X的原子最外层电子数是其内层电子数的三倍 |
| Y |
在第三周期的所用金属离子中,Y的离子半径最小 |
| Z |
Z与Y同周期,是所在周期中原子半径最小的元素 |
| T |
T的单质能与冷水剧烈反应,生成的强碱电离出两种电子数相等的阴、阳离子 |
(1)元素T与X按原子个数比1:1形成的化合物B的电子式为 ,该化合物中所含的化学键有 (填化学键名称)。
(2)单质T与冷水反应的化学方程式为
(3)将Y与Z形成的化合物的水溶液,逐滴加入到T的最高价氧化物对应水化物的溶液中直至过量(边滴加边振荡),写出此过程中发生反应的离子方程式
、 。
已知一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
(1)原NaOH溶液的质量分数为;
(2)所得溶液中Cl-的物质的量为mol;
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=。
将含有C、H、O的有机物3.0g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过装有CaCl2(A)和碱石灰(B)的干燥管,测得A管质量增加了1.8 g,B管质量增加了4.4 g,已知该有机物的相对分子质量为60。(1)燃烧此有机物3.0 g需消耗O2(标准状况)L;(2)求此有机物的分子式。
如下图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰。现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题。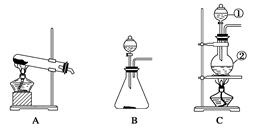
(1)选用A装置可制取的气体有;选用B装置可制取的气体有;通常选用C装置制取的气体有。若用亚硫酸钠和浓硫酸来制取二氧化硫气体应选用装置(填装置的编号字母)。
(2)写出利用上述有关药品制取氯气的化学方程式:。
(3)若要制得干燥的氨气,可选用下列干燥剂中的(填序号)。
A.生石灰 B.浓硫酸 C.五氧化二磷
(4)标号①的仪器除可用于在气体发生装置中添加试剂外,在实验中常用于(填实验操作名称)。
在试管A中加入3mL乙醇,然后边振荡管边慢慢加入2mL浓硫酸和2mL乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯。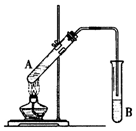
(1)试管B中盛放的试剂是(填名称),实验时往往在B试管中可以看到少量气泡,写出与此现象对应的离子方程式。
(2)乙醇与乙酸反应的化学方程式是。
(3)实验完成后,试管B的液面上有透明的不溶于水的油状液体产生。若要分离B中的液体混合物需要用到的玻璃仪器是。
(4)用30g乙酸与46g乙醇反应,如果实验产率是理论产率的60%,则可得到的产物质量是g。
(5)某同学采用“CH3CH218OH”做该实验,结果含18O原子的产物的结构简式为,乙酸分子的官能团名称为,乙酸在反应中被取代的原子团的电子式为。
已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):
Cu+2H2SO4(浓)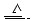 CuSO4+A↑+2H2O
CuSO4+A↑+2H2O
试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于(用字母代号填写)
A.酸 B.碱 C.盐D.酸性氧化物 E.碱性氧化物
A物质可以使酸性KMnO4溶液褪色,此反应中(填写化学式,下同)失去电子,氧化剂是。
(2)若A物质通入品红溶液,观察到溶液褪色,说明A物质具有(填序号,下同);若A物质通入Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有。
A.氧化性 B.还原性 C.漂白性
若A物质通入双氧水,请大胆判断所得溶液是(填溶质的化学式)
(3)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的A气体在标准状况下体积为L (假设气体全部逸出)。若用4 mol·L-1的NaOH溶液吸收生成的A,并生成正盐,写出发生的反应方程式计算需要NaOH溶液的体积L。