油炸食品因为良好的口感而受到人们的喜爱,但近来科学家不断发现:当植物油被加热到油炸的温度(即185℃),炸30分钟或更长时间,对人体健康有益的亚油酸被氧化为高毒性的4-羟基-2-壬烯醛(简称HNE);富含淀粉类的油炸食品(如炸薯条等)在高温烹制过程中会产生有毒性的丙烯酰胺(它们的结构简式如下图)。因此,人们应尽可能避免长期食用油炸食品,提倡合理营养,平衡膳食。
CH2=CHCONH2 (可简写为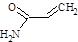 )
) 
丙烯酰胺的结构简式 HNE的结构简式
(1)HNE的分子式是_________,丙烯酰胺分子中存在的官能团是____________(填官能团名称)。
(2)下列关于HNE性质描述正确的是_________。
| A.该物质能使溴的四氯化碳溶液褪色 |
| B.该物质既可以被氧化也可以被还原 |
| C.该物质能发生取代反应 |
| D.该物质不能发生加聚反应 |
E.该物质可发生消去反应
(3)每1 mol HNE最多能与_________mol H2发生反应。
(4)丙烯酰胺在酸性条件下可水解为丙烯酸,写出它在足量盐酸中水解的反应方程式_________________________________________。
(5)聚丙烯酰胺在工业上有广泛的用途,可用于污水处理、纸加工、橡胶的合成等方面。写出由丙烯酰胺在一定条件下制取聚丙烯酰胺的化学方程式__________________
U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。请回答下列问题:
(1)V的单质分子的结构式为_______;XW的电子式为________;Y元素在周期表中的位置是___。
(2)U元素形成的同素异形体的晶体类型可能是(填序号)。
① 原子晶体② 离子晶体③ 分子晶体④ 金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)___________;
V、W的氢化物分子结合H+能力较强的是(写化学式)______________。
(4)YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为_________;由此可知VW和YW2还原性较强的是(写化学式)__________________。
银器皿日久表逐渐变成黑色,这是由于生成了Ag2S,有人设计了用原电池原理加以除去,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中与容器接触,放置一段时间,黑色就会褪去而不会损失。试回答:
在此原电池反应中,负极发生的反应为:__________________,正极反应为:________,反应过程中产生臭鸡蛋气味的气体,则原电池总反应方程式为:____________。
(1)铅蓄电池放电时发生下列反应负极:Pb+SO42--2e-=PbSO4正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O,用该电池电解CuSO4溶液,当有纯铜1.6g析出时,铅蓄电池内消耗硫酸物质的量为_______。
(2)锌、溴蓄电池的充、放电的电池总反应为Zn+Br2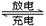 Zn2++2Br-。下列各反应①Zn-2e-====Zn2+②Br2+2e-====2Br-③2Br--2e-====Br2④Zn2++2e-====Zn,其中充电时的阳极反应式为,放电时负极的反应式是。
Zn2++2Br-。下列各反应①Zn-2e-====Zn2+②Br2+2e-====2Br-③2Br--2e-====Br2④Zn2++2e-====Zn,其中充电时的阳极反应式为,放电时负极的反应式是。
(3)目前人们正研究开发一种高能电池一—钠硫电池,它是以熔融的钠、硫为两极,以Na+导电的β,,——Al2O3陶瓷作固体电解质,反应如下:2Na+xS 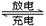 Na2Sx,其正极反应式为,当外电路转移4mol电子时消耗硫单质的质量为。
Na2Sx,其正极反应式为,当外电路转移4mol电子时消耗硫单质的质量为。
工业上处理含Cr2O72-的酸性工业废水用以下方法:①往工业废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准。试回答:
(1)电解时的电极反应:阳极阴极:;
(2)写出Cr2O72-转变成Cr3+的离子反应方程式;
(3)电解过程中Cr(OH)3、Fe(OH)3沉淀是怎样产生的?。
从H+、Na+、Cu2+、Ba2+、Cl—、SO42—离子中,选出恰当的离子组成一种电解质,将电解质溶液按下列要求进行电解(均是惰性电极):
(1)电解时电解质含量减小,水量不变,则所采用的电解质是;
(2)电解时电解质的质量保持不变,水量减小,则所采用的电解质是;
(3)电解时电解质和水的质量都发生变化,则所采用的电解质是;