某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。请回答下列问题: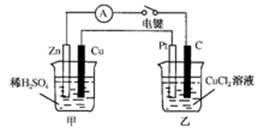
(1)甲装置的名称是_______;乙装置的名称是_______;Zn为_______极;Pt为______极。
(2)写出电极反应式:Cu极________________;C极________________。
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色______(填“变深”、“变浅”或“无变化”)。
(4) 若乙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将________(填“增大”、“减小”或“不变”,下同);乙中溶液的pH将________。
由废铁制备FeCl2的主要过程如下:
Ⅰ.按下图所示过程制备FeCl3•6H2O 
(1)①中产生气体的电子式是。
(2)用离子方程式表示过程②中稀硝酸的作用,在该过程中要不断向溶液中补充盐酸,目的是。
Ⅱ.由FeCl3 • 6H2O制得干燥FeCl2的过程如下:
ⅰ.向盛有FeCl3 • 6H2O的容器中加入SOCl2,加热,获得无水FeCl3
ⅱ.将无水FeCl3置于反应管中,通入①中产生的气体一段时间后加热,生成FeCl2
ⅲ.收集FeCl2,保存备用
(3) SOCl2与水接触会迅速产生白雾和SO2。加热分解FeCl3 • 6H2O不能得到无水FeCl3,而步骤ⅰ中可得到无水FeCl3,结合必要化学方程式解释得到无水FeCl3的原因。
(4)过程ⅱ中产生FeCl2的化学方程式是。
Ⅲ.FeCl2的包装上贴有安全注意事项,部分内容如下:
| 品 名 |
氯化亚铁 |
| 理化特性 |
白色,遇空气易变成黄色,易吸水,有腐蚀性…… |
| 注意事项 |
避免接触空气、碱等;聚乙烯塑料桶包装;避免受热 |
(5)下列说法正确的是。
a.密闭保存、远离火源
b.可以与强氧化剂共同存放、运输
c.不宜用铁制容器包装而要用聚乙烯塑料桶包装
(6)FeCl2在空气中受热可生成氯化铁、氧化铁等,反应的化学方程式是。
硅是信息产业、太阳能电池光电转化的基础材料。锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意如下: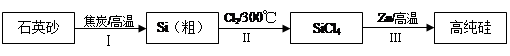
(1)焦炭在过程Ⅰ中作______剂。
(2)过程Ⅱ中的Cl2用电解饱和食盐水制备,制备Cl2的化学方程式是。
(3)整个制备过程必须严格控制无水。
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应的化学方程式是。
②干燥Cl2时,从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入到浓H2SO4中。冷却的作用是。
(4)Zn还原SiCl4的反应如下:
反应1:400℃~756℃ ,SiCl4(g) + 2Zn(l)  Si(s) + 2ZnCl2(l) ΔH1 <0
Si(s) + 2ZnCl2(l) ΔH1 <0
反应2: 756℃~907℃ ,SiCl4(g) + 2Zn(l)  Si(s) + 2ZnCl2(g) ΔH2 <0
Si(s) + 2ZnCl2(g) ΔH2 <0
反应3: 907℃~1410℃,SiCl4(g) + 2Zn(g)  Si(s) + 2ZnCl2(g) ΔH3 <0
Si(s) + 2ZnCl2(g) ΔH3 <0
① 对于上述三个反应,下列说法合理的是_____。
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应的速率 d.Na、Mg可以代替Zn还原SiCl4
② 实际制备过程选择“反应3”,选择的理由是。
③ 已知Zn(l)=Zn(g) ΔH =" +116" KJ/mol 。若SiCl4的转化率均为90%,每投入1mol SiCl4,“反应3”比“反应2”多放出_____kJ的热量。
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,采用化学腐蚀法在其表面形成粗糙的多孔硅层。腐蚀剂常用稀HNO3和HF的混合液。硅表面首先形成SiO2,最后转化为H2SiF6。用化学方程式表示SiO2转化为H2SiF6的过程。
二氧化钛广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下: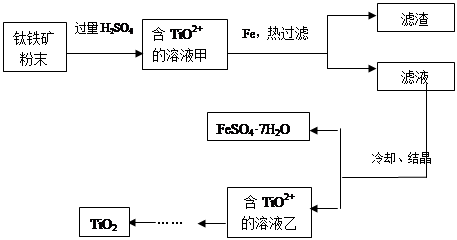
(1)Fe2O3与H2SO4反应的离子方程式是_________________________________。
(2)甲溶液中除含TiO2+之外还含有的金属阳离子有__________________。
(3)加Fe的作用是_________________________________。
方法2:TiCl4水解生成TiO2·x H2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(4)① TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________;
② 检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
Ⅱ.二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下:
反应②的方程式是,该反应需要在Ar气氛中进行,请解释原因:_____________。
硫酸盐在生产生活中有广泛应用。
Ⅰ.工业上以重晶石(主要成分BaSO4)为原料制备BaCl2,其工艺流程示意图如下:
某研究小组查阅资料得:
BaSO4(s)+4C(s) 4CO(g)+BaS(s)△H1=+571.2kJ•mol-1①
4CO(g)+BaS(s)△H1=+571.2kJ•mol-1①
BaSO4(s)+2C(s) 2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1 ②
2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1 ②
(1)用过量NaOH溶液吸收气体,得到硫化钠。该反应的离子方程式是。
(2)反应C(s)+CO2(g) 2CO(g)的△H= 。
2CO(g)的△H= 。
(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的有两个
①从原料角度看,;
②从能量角度看,①②为吸热反应,炭和氧气反应放热维持反应所需高温。
(4)该小组同学想对BaSO4在水中的沉淀溶解平衡做进一步研究,查资料发现在某温度时BaSO4在水中的沉淀溶解平衡曲线如图所示。
该小组同学提出以下四种观点:
①当向含有SO42-的溶液中加入Ba2+ 使SO42-沉淀完全,则此时SO42-在溶液中的浓度为0
②加入Na2SO4可以使溶液由a点变到b点
③通过蒸发可以使溶液由d点变到c点
④d点无BaSO4沉淀生成
其中正确的是(填序号)。
Ⅱ.某燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为2H2+O2═2H2O。
请回答:
(5)H+由极通过固体酸电解质传递到另一极(填a或者b)。
(6)b极上发生的电极反应是 。
短周期元素X、Y、Z原子序数依次递增。X、Y、Z的最外层电子数之和为13,Y是所在周期中金属性最强的,X、Z在同一主族。
(1)Z元素在周期表中的位置是。
(2)Y2ZX3溶液显性,能证明该溶液中存在水解平衡的事实是(填序号)。
a.滴入酚酞溶液变红,再加入稀H2SO4红色退去
b.滴入酚酞溶液变红,再加入氯水红色退去
c.滴入酚酞溶液变红,再加入BaCl2溶液产生沉淀且红色退去
(3)化合物Cu2X和Cu2Z可发生如下转化(其中D是纤维素水解的最终产物):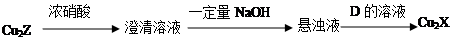
① D的化学式是;
② Cu2X与浓硝酸反应有红棕色气体生成,则化学反应方程式是。
(4)某温度下,在一个5L的密闭容器中充入0.2 mol ZX2和0.1 mol X2,20 s后达到平衡,测得容器中含有0.18 mol ZX3,则用X2表示该反应的平均速率是v(X2) =,此温度下该反应的化学平衡常数K=。