(10分) 铝是一种重要金属:
(1)生产中曾用铝热反应(铝与铁的氧化物反应生成氧化铝和铁)焊接钢轨,则铝与磁性氧化铁发生反应的化学方程式为 。该反应中氧化剂是 ,还原剂是 ,要得到1mol金属铁,需要铝的质量 g。(2) 铝与NaOH溶液反应的离子方程式为: 。在同温同压下,等质量铝投入足量盐酸和NaOH溶液中,产生气体的体积之比为 。
(1)有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀;将A、D分别投入等浓度盐酸中,D比A反应剧烈;将铜浸入B的盐溶液里,无明显变化;如果把铜浸入C的盐溶液里,有金属C析出。据此,判断它们的活动性由强到弱的顺序是
(2)下列装置可防止铁棒被腐蚀的是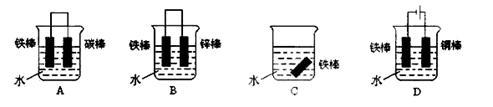
(3)将经过酸洗除锈的铁钉,用饱和食盐水浸泡后放入如图所示装置中,过一段时间观察,导管中的水柱会上升,说明发生的是(填“吸氧腐蚀”或“析氢腐蚀”)。写出相关的电极反应式:负极,正极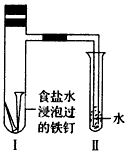
氨气主要用作致冷剂及制取铵盐和氨肥
(1)某研究小组在673K、30MPa条件下,在体积为VL的密闭容器中进行反应:N2(g)+3H2(g)⇌2NH3(g),其n(H2)和n(NH3)随时间变化的关系如图所示.
下列叙述正确的是.
| A.点a的正反应速率比点b的大 |
| B.点c处反应达到化学平衡状态 |
| C.若t3时由673K升至773K,则n(H2)将增大 |
| D.t2、t3时刻,n(N2)不相等 |
(2)在一定温度和催化剂下,将6.4mol H2和2.4molN2混合于一个容积为4L的密闭容器中发生反应,在3min末时反应恰好达平衡,此时生成了1.6mol NH3.①3min内以H2表示的化学反应速率;②该条件下的平衡常数
(3)已知:N2(g)+O2(g)=2NO(g)△H= +180.5kJ/mol
N2(g)+3H2(g)⇌2NH3(g)△H= -92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H= -483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
如图为相互串联的甲乙两个电解池,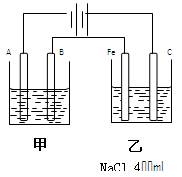
请回答:
(1)甲池若为电解精炼铜的装置,A极是,材料是,电极反应为,B极是,材料是,电极反应为。
(2)若甲槽阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为。
(3)若乙槽剩余液体为400mL,求电解后得到碱液的物质的量浓度。
在一定体积的密闭容器中,进行如下化学反应:
C(s)+H2O(g)  CO(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
| t/(℃) |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.7 |
0.8 |
1.0 |
1.6 |
2.4 |
(1)该反应的化学平衡常数表达式为K=________,该反应为________反应(填“吸热”或“放热”)。
(2)能作为判断反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.c(H20)不变
C.v正(H2)=v逆(H2O) D.c(H2)=c(CO)
(3)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,缩小容器的体积,平衡________移动(填“正向”、“逆向”或“不”)。H2O(g)的浓度_______,CO(g)的浓度_______(填“变大”、“不变”或“变小”)
Ⅰ.在一个容积固定为2L的密闭容器中,发生反应:aA (g) + bB(g)  pC(g) ,△H=?,反应情况记录如下表:
pC(g) ,△H=?,反应情况记录如下表:
| 时间/(min) |
n(A)/( mol) |
n(B)/( mol) |
n(C)/( mol) |
| 0 |
1 |
3 |
0 |
| 第2 min |
0.8 |
2.6 |
0.4 |
| 第4 min |
0.4 |
1.8 |
1.2 |
| 第6 min |
0.4 |
1.8 |
1.2 |
| 第8 min |
0.1 |
2.0 |
1.8 |
| 第9 min |
0.05 |
1.9 |
0.3 |
请根据表中数据仔细分析,回答下列问题:
(1)第2min到第4min内A的平均反应速率v(A)=mol•L-1• min-1
(2)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、第6min、第8 min时分别改变了某一个反应条件,则改变的条件分别可能是:
①第2min或;
②第6min;③第8 min。
(3)若从开始到第4 min建立平衡时反应放出的热量为235.92kJ则该反应的△H=。
(4)反应在第4 min建立平衡,此温度下该反应的化学平衡常数K=。
(5) 判断第9 min时是否达平衡,说明理由。
Ⅱ.已知:常温下,A酸的溶液pH=a, B碱的溶液pH=b
(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为。
A.大于7 B.等于7 C.小于7
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为mol•L-1,B溶液中水电离出的氢离子浓度为mol•L-1。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为:。