T ℃时,某NaOH溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如表中所示:
| 序号 |
NaOH溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
| ① |
20.00 |
0.00 |
8 |
| ② |
20.00 |
20.00 |
6 |
假设溶液混合前后的体积变化忽略不计,则c为
A.3 B.4 C.5 D.6
某温度下,将0.2 mol C(s)和0.3 mol H2O(g),投入2 L的密闭容器中,发生反应C(s)+H2O(g) CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是
CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是
| A.从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 mol·L-1·min-1 |
| B.达平衡时压强变为原来的7/6 |
| C.此温度下该反应的平衡常数为0.005 |
| D.若保持温度和体积不变,向平衡体系中再加入0.2 mol C(s)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7% |
常温下,含a mol CH3COOH和b mol NaOH的两溶液混合后,下列推论不正确的是
| A.若a≤b,混合液的pH一定小于7 |
| B.若a=2b,则混合液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| C.混合液中,c(Na+)+c(H+)=c(OH-)+c(CH3COO-)一定成立 |
| D.当混合液的pH>7时,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)一定成立 |
处于同一周期的A、B、C、D四种短周期元素,其气态原子获得一个电子所放出的能量A>B>C>D。则下列关于A、B、C、D四种元素的说法中,正确的是
A.元素的非金属性依次增强B.元素的电负性依次减小
C.元素的第一电离能依次增大D.最高价氧化物对应水化物的酸性依次减弱
下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是
| A.Na+(g)+Cl-(g)===NaCl(s) ΔH | B.Na(s)+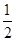 Cl2(g)===NaCl(s) ΔH1 Cl2(g)===NaCl(s) ΔH1 |
| C.Na(g)-e-===Na+(g) ΔH2 | D.Cl(g)+e-===Cl-(g) ΔH3 |