键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的化学键能之和的差。参考以下表格的键能数据,回答下列问题:
| 化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
| 键能/KJ.mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
(1)比较下列两组物质的熔点高低(填“>”“<”)
SiC_______Si; SiCl4_______SiO2
(2)能否根据键能的数据判断单质Si晶体和化合物SiCl4的熔点高低? (填“能”或“不能”)原因是:
(3)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g),计算该反应的反应热△H为 。
Si(s)+4HCl(g),计算该反应的反应热△H为 。
回答下列问题:


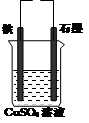
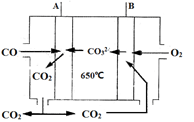
图1图2图3
(1)如图1所示为氯碱工业的模拟装置。反应的离子方程式是 。
A、B、C、D所对应物质化学式分别为 、 、 、 ,
每通过0.1mol电子,就有0.1mol (填离子符号)通过离子交换膜。
(2)在如图2所示实验装置中,石墨棒上的电极反应式为________________;总反应的化学方程式是 。
如果起始时盛有1000 mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1。若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入___________(填物质名称),其质量约为___________g。
(3)熔融碳酸盐CO燃料电池工作原理如图3所示,A、B极的电极反应分别是 、 。
回答下列问题:
(1)“霾”是当今世界环境热点话题。目前宁夏境内空气质量恶化原因之一是机动车尾气和燃煤产生的烟气。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:2NO(g)+ 2CO(g) 2CO2(g)+N2(g) △H=﹣a kJ·mol-1(a>0)
2CO2(g)+N2(g) △H=﹣a kJ·mol-1(a>0)
在一定温度下,将2.0mol NO、2.4mol CO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:
①0~15min N2的平均速率v(N2)= ;NO的转化率为 。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是 (选填序号)。
A.缩小容器体积 B.增加CO的量
C.降低温度 D.扩大容器体积
③其它条件不变,按以下选项充入起始物质,各物质体积分数仍然不变的是 。
A.4.0mol NO、4.8mol CO
B.1.0mol NO、1.2mol CO、1.0mol CO2、0.5mol N2
C.1.6mol NO、2.0mol CO、0.4mol CO2、0.2mol N2
D.0.4mol CO、2.0mol CO2、1mol N2
(2)实验室配制FeCl3溶液时,将FeCl3固体溶解在稀盐酸中,请结合离子方程式用平衡移动原理解释原因 。
(3)“氯胺(NH2Cl)消毒法”是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2+NH3=NH2Cl+HCl。NH2Cl能与水反应生成可以杀菌消毒的物质(元素化合价不变)。
①NH2Cl与水反应的化学方程式是 。
②在Cl2+NH3=NH2Cl+HCl中,每消耗0.5mol Cl2,转移电子____________mol。
回答下列问题:
(1)已知两种同素异形体A、B的燃烧热的热化学方程式为:
A(s)+O2(g)= CO2(g) △H=-393.51kJ/mol
B(s)+O2(g)= CO2(g) △H=-395.41kJ/mol
则两种同素异形体中较稳定的是(填“A”或“B”) 。
(2)工业上用H2和Cl2反应制HCl,各键能数据为:H-H:436kJ/mol,Cl-Cl:243kJ/mol,H-Cl:431kJ/mol。该反应的热化学方程式是 。
(3)合成气(CO和H2为主的混合气体)不但是重要的燃料也是重要的化工原料,制备合成气的方法有多种,用甲烷制备合成气的反应为:
①2CH4(g)+O2(g) 2CO(g)+4H2(g);ΔH1="-72" kJ·mol-1
2CO(g)+4H2(g);ΔH1="-72" kJ·mol-1
②CH4(g)+H2O(g) CO(g)+3H2(g);ΔH2="+216" kJ·mol-1
CO(g)+3H2(g);ΔH2="+216" kJ·mol-1
氢气与氧气反应生成水蒸气的热化学方程式为 。
现有1 mol由H2O(g)与O2组成的混合气,且O2的体积分数为x,将此混合气与足量CH4充分反应。
若x=0.2时,反应①放出的能量为 kJ。
若x= 时,反应①与②放出(或吸收)的总能量为0。
某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、AlO2﹣、SO42﹣、SiO32﹣、CO32﹣、Cl﹣中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成.
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失.
(1)肯定不存在的离子是 .
(2)写出步骤②中生成沉淀和气体的反应的离子方程式 .
(3)已知一定量的原溶液中加入5mL 0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187g,则原溶液中是否含有Cl﹣? (填“有”或“无”).
在一体积不变的密闭容器中进行如下反应:2X(g)+Y(g)  2W(g);反应前按n(X)∶n(Y)=3∶1加入反应物,反应过程中W的物质的量随时间的变化如图所示。
2W(g);反应前按n(X)∶n(Y)=3∶1加入反应物,反应过程中W的物质的量随时间的变化如图所示。
(1)分析曲线A和B的不同,可能是以下_____ ___原因造成的。
A.是否使用催化剂 B.反应温度不同
C.外界的压强不同 D.初始充入的反应物的物质的量不同
(2)该反应的化学平衡常数为K,比较K500℃___ _____K600℃(填“>”、“<”或“=”)。
(3)如果曲线B达到平衡时,体系的压强为反应前的85%,当容器的体积为1 L时,计算:曲线A从开始达到平衡,X的反应速率v(X)为____________。起始时加入Y的物质的量为______________mol。不通过计算能否判断出X、Y转化率是否相同_________________(填“能”或“否”)。
(4)说明该反应已达到平衡状态的是_________________。
A.v正(W)=v逆(W) B.c(X)=c(W)
C.气体的平均摩尔质量不变 D.气体的密度保持不变