已知下列热化学方程式:
①CaCO3(s)=CaO+CO2(g);△H=177.7KJ
②C(s)+H2O(s)=" CO(g)+" H2(g);△H=-131.3KJ/mol
③ H2SO4(l)+NaOH(l)=
H2SO4(l)+NaOH(l)=  Na2SO4(l)+ H2O(l);△H=-57.3KJ/mol
Na2SO4(l)+ H2O(l);△H=-57.3KJ/mol
④C(s)+O2(g)= CO2(g) ;△H=-393.5KJ/mol
⑤CO(g)+  O2(g)= CO2(g);△H=-283KJ/mol
O2(g)= CO2(g);△H=-283KJ/mol
⑥HNO3(aq)+ NaOH(aq)= NaNO3(aq)+H2O(l) ;△H=-57.3KJ/mol
⑦2H2(g)+O2(g)=2H2O(l):△H=-517.6KJ/mol
(1)上述热学方程式中,不正确的有 ,(填编号),不正确的理由分别是 。
(2)根据上述信息,写出C转化为CO的热化学方程式 。
(3)上述反应中,表示燃烧热的热化学方程式有 (填编号)表示中和热的热化学方程式有 。(填编号)
某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示:
| 检测次数 |
溶液中检测出的物质 |
| 第1次 |
KCl、K2SO4、Na2CO3、NaCl |
| 第2次 |
KCl、BaCl2、Na2SO4、K2CO3 |
| 第3次 |
Na2SO4、KCl、K2CO3、NaCl |
查阅资料:Ag2SO4、CaSO4微溶于水
(1)三次检测中,检测结果肯定不正确的是。
(2)SO42-、CO32-和Cl-的检测最佳顺序是。
(3)在上述检测中,若只取一次某溶液:
①检测SO42-时,所用试剂是。
②检测CO32-时,所加试剂必须过量的原因是。
③检测Cl-时,请写出其中的一个有关反应化学方程式是。
选择下列一种方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液 |
| B.升华 |
| C.结晶 |
| D.分液 |
E.蒸馏
F.过滤
(1)从溴水中提取溴______________
(2)从含有少量氯化钠的硝酸钾混合液中获得硝酸钾___________
(3)分离水和汽油的混合物___________
(4)分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)两种互溶液体______
在下列物质中选择溶于水后可以电离的物质,并写出相应的电离方程式(有几个写几个):①硝酸铵(NH4NO3)②葡萄糖[C6H12O6] ③氢氧化钡[Ba(OH)2]④硫酸(H2SO4)⑤四氯化碳(CCl4)
。
已知CaO2与水的反应同Na2O2与水的反应类似,今有某过氧化钙(CaO2)产品(杂质只含CaO):
(1)称取此产品10g,与足量盐酸充分反应,得到O2 1120mL(标准状况),则该产品中(CaO2)的质量分数为________,此过程中转移的电子物质的量为。
(2)CaO2与水的反应较慢,因此可用作鱼池增氧剂。某养殖户鱼塘蓄水2000m3,为预防缺氧投入上述产品,最终共生成CaCO3 90kg,则该养殖户的投药量为g/m3(假设产品遇水生成的Ca(OH)2全部与鱼呼出的CO2反应生成CaCO3 )
金属铬和氢气在工业上都有重要的用途。已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4)。
(1)铜铬构成原电池如图1,其中盛稀硫酸烧杯中的现象为:。盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是: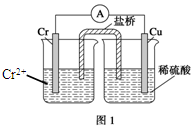
| A.盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KCl琼脂溶液 |
| B.理论上1molCr溶解,盐桥中将有2molCl-进入左池,2molK+进入右池 |
| C.此过程中H+得电子,发生氧化反应 |
| D.电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中 |
(2)如构成图2电池发现,铜电极上不再有图1的现象,铬电极上产生大量气泡,遇空气呈红棕色。写出正极电极反应式:。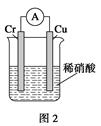
(3)某同学把已去掉氧化膜的铬片直接投入氯化铜溶液时,观察到了预料之外的现象:①铬片表面上的铜没有紧密吸附在铬片的表面而是呈蓬松的海绵状;②反应一段时间后有大量气泡逸出,且在一段时间内气泡越来越快,经点燃能发出爆鸣声,证明是氢气。
请解释这两种现象的原因____________________________________________