以海水中常见的物质A为原料可以发展很多种工业,下图中包含了几种基本工业生产,请根据各物质之间的转化关系。回答下列问题:
(1)C和D、C和G反应都可以制取消毒剂。C和G反应制取的消毒剂中有效成分的化学式为__________________________。
(2)将F和J通入A的饱和溶液中的顺序为_______________。
A.先通入F后通入J B.先通入J后通入F
C.同时通入 D.没有先后顺序要求
(3)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。
①检验沉淀是否洗涤干净所用到的试剂是______________________
②样品中NaCl的质量分数的数学表达式为__________________________
(16分)某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯: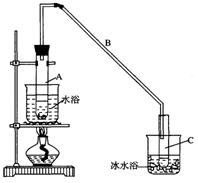
已知: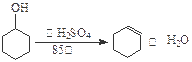
| 密度 (g/cm3) |
熔点 (℃) |
沸点 (℃) |
溶解性 |
|
| 环己醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是,导管B除了导气外还具有的作用是。
②试管C置于冰水浴中的目的是。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在层(填“上”或“下”),分液后用(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按图装置蒸馏,冷却水从口进入。蒸馏时要加入生石灰,目的是: 。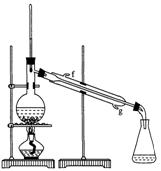
③收集产品时,控制的温度应在左右,实验制得的环己烯精品质量低于理论产量,可能的原因是。
A.蒸馏时从70℃开始收集产品 B.环己醇实际用量多了 C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是。
A.用酸性高锰酸钾溶液 B.用金属钠 C.测定沸点
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题: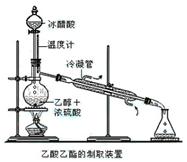
(已知:乙醇、乙酸、乙酸乙酯的
沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中加入一定比例的乙醇
和浓硫酸的方法是:
。
(2)在该实验中,若用1mol乙醇和1mol 乙酸在浓硫酸作用下加热,充分反应,生成乙酸乙酯的物质的量小于1mol,原因是。
(3)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。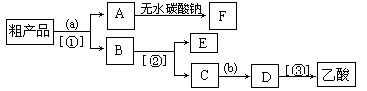
试剂a是__________;分离方法①是_________________,
分离方法②是__________________,分离方法③是_______________。
(4)在得到的A中加入无水碳酸钠粉末,振荡,目的是。
用实 验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸。其具体实验步骤如下:
验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸。其具体实验步骤如下:
①取一支碱式滴定管(如图有两只滴定管,你选择哪一只?)(填写对应字母),用少量标准NaOH溶液润洗2~3次水洗后的碱式滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确地放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中。再加入酚酞试液2滴;
③滴定时,边滴边振荡,同时眼睛注视锥 形瓶内溶液颜色的变化,当锥形瓶内溶液由
形瓶内溶液颜色的变化,当锥形瓶内溶液由
(填写颜色变化)且半分钟内不褪色时,即达到滴定终点;
④记录液面刻度读数。根据滴定管的两次读数得出消耗标准盐酸的体积,再重复测定两次,实验结果记录见下表:
| 实验次数 |
起始滴定管读数 |
终点滴定管读数 |
| 1 |
0.00mL |
24.02mL |
| 2 |
0.50mL |
24.46mL |
| 3 |
1.00mL |
25.02mL |
测得未知稀盐酸的物质的量浓度为(保留小数点后3位)。
⑤如果滴定结束时俯视碱式滴定管刻度读数(其它操作均正确),则对滴定结果稀盐酸浓度的影响是(填“偏高”、“偏低”或“无影响”)。
用下图所示实验装置制取乙酸乙酯。回答以下问题: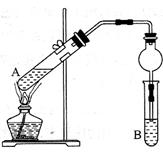
(1)在A试管中配置好体积比为3:2的乙醇和乙酸,加热至沸腾,很久都末有果香味液体生成,原因是
____________________________________________。
(2)B试管中所装溶液应为_________,乙酸乙酯生成后,将在该溶液的___________(填“上”或“下”)层,分离出产品所需的主要仪器是______________________。
(3)与教材采用的实验装置不同,这位老师采用球形干燥管代替长导管,并将干燥管的末端插入B中液面以下,在此处,球形干燥管的作用有
①________________________________,②______________________________。
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题: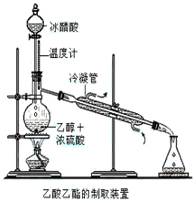
(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,
还应放入几块碎瓷片,其目的_____________。
(2)配制乙醇和浓硫酸的混合液的方法是:先在烧瓶中加入一定量的,然后慢慢将加入烧瓶,边加边振荡。
(3)在该实验中,若用1 mol乙醇和1 mol 乙酸在浓硫
作用下加热,充分反应,不能生成1 mol乙酸乙酯的原因是
。
(4)锥形瓶中得到乙酸、乙醇和水的乙酸乙酯的混合物,欲得到乙酸乙酯并闻到它的气味,需将混合液先用溶液处理,再用
(填一种仪器名称)分离。
(5)葡萄糖是生命现象中的一种能量物质。现取少量葡萄糖溶液于试管中,加入新制的Cu(OH)2悬浊液,加热煮沸后现象是,说明分子中含有的官能团是,反应的化学方程式是: