下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6 mol/L H2SO4溶液和NaOH溶液。填写下列空白: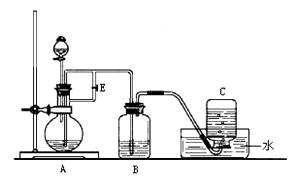
(1)B中盛有一定量的 ,A中应预先加入的试剂是 ,
A中反应的化学方程式为 。
(2)实验开始时应先将活 塞E (填“打开”或“关闭”),目的是
塞E (填“打开”或“关闭”),目的是
。
(3)A反应一段时间后将活塞E (填“打开”或“关闭”),目的是  。
。
(4)实验结束,拔去装置B中的橡皮塞,使空气进入,Fe(OH)2被氧化。若反应过程中转移了0.04mol电子,则参加反应的氧气的体积为 L(标准状况)。
Ⅰ.某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题。
(1)配制100mL1mol/L的NH4Cl溶液。该同学应用托盘天平称量NH4Cl固体的质量为g。
有以下仪器:烧杯、胶头滴管、玻璃棒等玻璃仪器。
①还缺少的仪器有;
②使用容量瓶前必须进行的一步操作是;
(2)该同学又用下图所示的装置做了有关氨气的性质实验。
①写出实验室制氨气的化学方程式:;
②写出B中盛放的是碱石灰其作用是;
③氨气极易溶于水,在氨水中滴加酚酞现象是;
④检验氨气的方法是。
Ⅱ.在稀硝酸中放入足量的铜片:
(1)反应的化学方程式为;
(2)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是。(用离子方程式表示)
(3)若将12.8g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6L(标
准状况下)。则所消耗的硝酸的物质的量是。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题: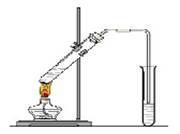
(1)写出制取乙酸乙酯的化学反应方程式。
(2)浓硫酸的作用是:①;②。
(3)饱和碳酸钠溶液的主要作用是。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
为了检验淀粉水解产物,某学生设计了如下实验方案:
回答下列问题:
(1)试剂1是,作用是;
(2)试剂2是,作用是;
(3)如果实验过程中没有加入试剂2而直接加入试剂3,能否实现实验目的,若不能,其原因是
(4)如何检验第①步实验已基本完成
(1)化学药品与人类健康息息相关。生活中常用药品很多,如:
A.碘酒 B.麻黄碱 C.青霉素 D.阿司匹林
E.葡萄糖注射液 F.胃舒平(含氢氧化铝、淀粉等) G.维生素C。
①上述药物中,在使用前一定要进行皮肤敏感试验(皮试)的是(填写序号)。
②具有解热镇痛药效的是。
③能给患者伤口消毒的药物是。
④氢氧化铝[Al(OH)3]是某些抗酸药的有效成分。请写出氢氧化铝与胃酸反应的离子方程式:。
(2)下面是某同学研究维生素C过程中的一个片段,请你帮他完成相应的记录。
[查阅资料]维生素C也称为抗坏血酸,是一种无色晶体。其水溶液显酸性。其化学特性是易失电子,在水溶液中或受热时易被氧化。
[实验探究]
| 实验内容 |
实验现象 |
| 向2mL维生素C溶液中滴加2滴紫色石蕊试液 |
溶液变为色 |
| 将维生素C的溶液逐滴加入到2mL溶有淀粉的碘水中 |
溶液由蓝色变为无色 |
[问题思考]
①生的新鲜蔬菜比炒熟的蔬菜所含维生素C(填“高”或“低”)
②维生素C可使食物中的Fe3+转化为Fe2+,这一过程体现了维生素C的(填“氧化性” 或“还原性”)
③医生建议患血病患者应多吃的食物是
实验室用燃烧法测定某种a一氨基酸X(CXHYOZNP)的分子组成。取1.67 g X放在纯氧中充分燃烧,生成CO2、H2O和N2。现用下图所示装置进行实验(铁架台、铁夹、酒精灯等未画出),请回答有关问题:
(1)实验开始时,首先打开止水夹a,关闭止水夹b,通一段时间的纯氧,这样做的目的是
。
(2)以上装置中需要加热的有(填装置代号) 。操作时应先点燃处的酒精灯。
(3)配平装置A中发生反应的化学方程式
CXHYOZNP+O2→CO2+H2O+N2
(4)装置D的作用是。
(5)实验结果:
①B中浓硫酸增重0.81 g,C中碱石灰增重3.52 g,F中收集到112 mL(标准状况)气体。
②x的相对分子质量为167,试通过计算确定该有机物X的分子式。