一定能够鉴定卤代烃中卤元素的存在的操作是( )
| A.在卤代烃中直接加入AgNO3溶液 |
| B.加蒸馏水,充分搅拌后,加入AgNO3溶液 |
| C.加入NaOH溶液,加热后加入稀硝酸酸化,再加入AgNO3溶液 |
| D.加入NaOH的乙醇溶液,加热后加入AgNO3溶液 |
有下列四组物质,每组物质中均有一种与其他物质所属类别不同
(1)食醋、牛奶、加碘盐、水
(2)冰、干冰、氧化铁、金刚石
(3)氯化钠、硫酸铜、盐酸、硝酸铝
(4)纯碱、烧碱、碳酸钙、氯化亚铁。则各组中的一种物质依次为:
| A.牛奶、干冰、硝酸铝、碳酸钙 |
| B.水、金刚石、盐酸、烧碱 |
| C.食醋、氧化铁、硫酸铜、氯化亚铁 |
| D.加碘盐、冰、氯化钠、纯碱 |
下列中的诗句内容基本不涉及化学变化的是
| A.王安石的《元日》 :“爆竹声中一岁除,春风送暖入屠苏” |
| B.刘禹锡的《浪淘沙》 :“美人首饰侯王印,尽是江中浪底来” |
| C.刘琨的《重赠卢谌》 :“ 何意百炼钢,化为绕指柔” |
| D.李商隐的《无题》 :“春蚕到死丝方尽,蜡炬成灰泪始干” |
向甲乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB。相同条件下,发生下列反应:A(g)+B(g) xC(g);△H<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是
xC(g);△H<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是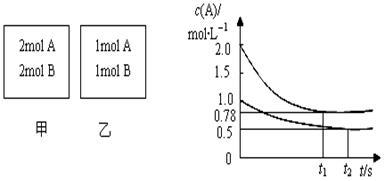
A.x可能等于2也可能等于3
B.向平衡后的乙容器中充入氦气可使c(A)增大
C.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
D.若向甲容器中再充入2molA、2molB,则平衡时甲容器中0.78mol·L-1<c(A)<1.56mol·L-1
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g),ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、容器体积的关系如下表所示:
nY(g),ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、容器体积的关系如下表所示:
 容器体积 容器体积温度 |
1 |
2 |
4 |
| 100 |
1.00 |
0.75 |
0.53 |
| 200 |
1.20[ |
0.90 |
0.63 |
| 300 |
1.30 |
1.00 |
0.70 |
下列说法正确的是
A.m>n
B.温度不变,压强增大,Y的质量分数减少
C.Q<0
D.体积不变,温度升高,平衡向逆反应方向移动
HM和HR的溶液分别加水稀释时pH变化如下图。下列叙述中正确的是
| A.HR可能是弱酸 |
| B.x点时c(R-)=c(M-) |
| C.HM是一种强酸 |
| D.稀释前,c(HR)=10c(HM) |